Search Thermo Fisher Scientific
TALEN 基因编辑技术信息
TALEN 或 TAL 效应子是一项广泛应用的技术,适合在活细胞中进行精确高效的基因编辑。这项基因组编辑技术以可在多种宿主系统中起效而著称,包括细菌、酵母菌、植物、昆虫、斑马鱼和哺乳动物。我们汇集了一系列资源,希望这些资源能让您更有信心开始并持续使用 TALEN 改进研究。
什么是 TALEN?
转录激活因子样 (TAL) 效应子蛋白由黄单胞菌属细菌(广泛分布的植物病原体)产生。天然 TAL 能与宿主 DNA 的特定序列结合,改变感染植物的基因表达,从而推进疾病进程。天然 TAL 效应蛋白具有两个不同的结构域:效应域和特异性极高的 DNA 结合域。
研究人员可通过改变 DNA 结合域的结构,产生可与基因组中任一 DNA 序列特异性结合的蛋白质结构域。然后,可以将这些特异性修饰的 DNA 结合蛋白结构域与所需要的效应域(例如核酸酶、转录激活因子或抑制因子)连接,以产生能够进行精确靶向 DNA 操作的嵌合蛋白。
无论是通过基因组工程的靶向核酸酶还是基因表达的精确定向调节器,研究人员设计的 TALEN 效应蛋白已经帮助推进了众多生命科学应用,包括细胞生物学、分子生物学与合成生物学、药物发现及生物燃料研究。
TALEN 是如何工作的?
TAL的DNA 结合域源自黄单胞菌 TAL 效应子,由可变数量的氨基酸重复片段组成。每个重复片段含有 33-35 个氨基酸并能够识别单个 DNA 碱基对。DNA 识别通过每个重复片段内称为重复可变的双氨基酸残基 (RVD) 的第 12 和 13 位两个高变氨基酸残基实现,如图 1 所示。
TAL 效应子重复片段可以进行模块化组装,通过改变 RVD 产生能够识别特定靶点 DNA 序列的 TAL 蛋白。重复片段连接简单直接,因而可以通过设计长 TAL 效应子特异性靶向基因组中的任何位点。

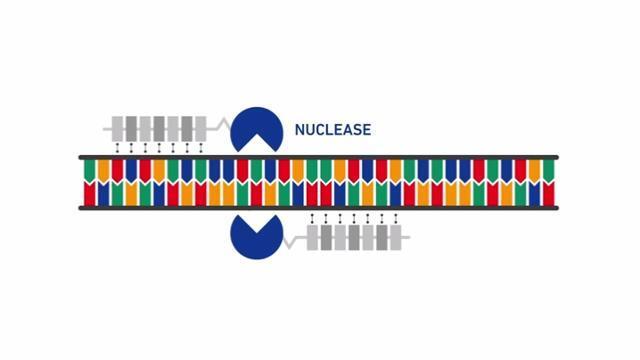
通过使用与 Fok1 核酸酶融合的一对 GeneArt TAL 蛋白,可在指定的基因组位点产生双链 DNA 断裂(图 2)。使用一对 TAL 蛋白进行靶向,可降低脱靶效应。
由 Fok1 核酸酶结构域诱导的断裂随后会通过两种内源性细胞机制之一进行修复:非同源末端连接 (NHEJ) 或同源定向修复 (HDR)。
- 其中,NHEJ 易错配,且发生在蛋白质编码基因的编码序列内时往往会引入移码突变,从而有效沉默基因
- 在 HDR 中,可使用同源 DNA“供体序列”来引入一个确定的新 DNA 序列
因此,与 Fok1 核酸内切酶融合的蛋白可用于诱导基因沉默或将工程改造 DNA 片段精确插入基因组特定位置。
了解更多有关 TALEN 技术的信息

应用指南:使用 Sanger 测序加快 CRISPR 和 TALEN 介导的基因组编辑工作流程
了解 Sanger 毛细管电泳测序及 Minor Variant Finder 软件如何应用于基因组编辑工作流程。本文展示了 CRISPR 介导的基因编辑结果,但其原理也可以用于 ZFN 或 TALEN 介导的基因编辑工作流程。由于该工作流程简单且性价比高,数据分析简单,Sanger 毛细管电泳测序已成为任何基因组编辑工作流程的重要组成部分。

博客: 科学家直通车 - Jon Chesnut 谈 CRISPR 与 TALEN
CRISPR 和 TALEN 工具和技术正在改变当前和未来的基因编辑方式,但这两者之间有何区别?何种情况下应选用其中一种技术,舍弃另一种技术?这篇文章将为您解答以上问题和更多其他问题。

基因组编辑资源库
访问关于基因组编辑的科学应用说明、出版物、视频、网络研讨会和科学墙报的目标集合。

基因组编辑资源指南
该指南为基因组编辑简介,涵盖了目前可用于基因编辑的所有技术,以及编辑细胞的设计、递送和检测方法。
TALEN 技术的更多资源和支持
仅供科研使用,不可用于诊断目的。