Search Thermo Fisher Scientific
ELISAに関する概要
目次
Please Configure List Items!対象製品
Please Configure List Items!はじめに
通常ELISAは、96ウェル(または384ウェル)ポリスチレンプレート上で実行され、抗体やタンパク質へ受動的に結合します。試薬のこうした結合や固定化の特性のおかげで、ELISAのデザインと実行は非常に簡単になります。.ELISAで得られた反応物をマイクロプレート表面へ固定化すると、アッセイ中に非結合物質からの結合を分離しやすくなります。非特異的な結合物質を除去するこうした能力は、ELISAが粗調製物中の特定検体の測定用ツールとして有用である所以です。
検出酵素やタグ類は、一次抗体へ直接結合させたり、一次抗体を認識する二次抗体へ導入させることができます。また、一次抗体がビオチン標識されていれば、ストレプトアビジンなどのタンパク質へこの検出酵素やタグ類を結合させることも可能です。代表的な酵素標識として、西洋ワサビペルオキシダーゼ(HRP)およびアルカリホスファターゼ(AP)が利用されています 。他の酵素が利用されることもありますが、基質オプションが限られているため、広く普及するには至っていません。その他酵素としては、β-ガラクトシダーゼ、アセチルコリンエステラーゼおよびカタラーゼなどが挙げられます。HRPコンジュゲートやAPコンジュゲートを用いたELISAを実行する用途に、豊富な種類の基質を取り揃えています。所要アッセイ感度や信号検出に利用可能な機器タイプ(例:分光光度計、蛍光光度計または照度計)に準じて、基質をご選択ください。
ELISAの各フォーマット
ELISAは、基本となるプロトコルに様々な変更を加えたうえで実行することが可能です。目的抗原を固定化させる重要な工程を達成するには、アッセイプレートへ抗原を直接吸着させるか、もしくはプレートに結合した捕捉抗体を介して、抗原を間接的に吸着させます。これにより、直接的(標識一次抗体)あるいは間接的(標識二次抗体)に抗原が検出されます。サンドイッチアッセイは、ELISAアッセイの中でも最も有効性の高いフォーマットです。このタイプの捕捉アッセイは、測定対象の検体が2つの一次抗体(捕捉抗体と検出抗体)間に結合していることから、「サンドイッチ」アッセイと呼ばれています。サンドイッチアッセイは、高感度かつ堅牢なフォーマットである理由から活用されています。
標準的な各ELISAフォーマットの比較図(直接アッセイとサンドイッチアッセイ)

直接検出法と間接検出法による各ELISAの比較
前項で図解によりご紹介した標準アッセイ各フォーマットでは、捕捉と検出の相違が重要点となり、検出工程に特有な各特殊戦略を識別することが不可欠です。たとえ抗原がプレート上に捕捉されている(サンドイッチELISAと同様に、表面への直接吸着、あるいはプレコート「捕捉」抗体を介して捕捉)場合でも、ELISAにおける感度は、主に検出工程(直接検出または間接検出いずれか)により決定付けられます。
以下の動画では、ELISAにおける検出とシグナル増幅の各戦略をご紹介いたします
直接検出法では、抗原と直接反応する標識済み一次抗体を使用します。直接検出を行うには、アッセイプレート上に直接固定化された抗原、もしくは捕捉アッセイの方式を活用します。直接検出法は、ELISAの代表的手法ではありませんが、組織や細胞を免疫組織化学的に染色する用途に非常によく利用されています。
ELISAの代表的方式である間接検出法では、標識済み二次抗体を用いて検出を行います。二次抗体には、一次抗体に対する特異性があります。サンドイッチELISAでは、二次抗体が、(捕捉抗体ではなく)検出一次抗体に対してのみ特異性を有していることが重要です。そうでない場合には、アッセイには抗原に対する特異性を持たなくなります。通常、これは別々の宿主種由来の捕獲抗体や一次抗体を用いて実行されます (例:それぞれ、捕獲抗体にはマウスIgG、一次抗体にはウサギIgG)。サンドイッチアッセイでは、交差吸着した二次抗体を使用すると、効果的に捕捉抗体に親和性の抗体を除去することができます。
| ELISA直接検出法 | |
|---|---|
| 利点 |
|
| 欠点 |
|
| ELISA間接検出法 | |
|---|---|
| 利点 |
|
| 欠点 |
|
プレートベースのアッセイには、蛍光タグや酵素ベース検出法の代替え物質を利用できます。これらの手法は、レポーター酵素へ関与しませんが、一般的にはELISAの一種とされています。同様に、プレートベースの手法で検出可能プローブと特異的タンパク質結合相互作用を活用できる場合であれば、これらのアッセイは、(抗体へ関与しないにも関わらず)ELISAと呼ばれます。
その他のELISA方式
上記の標準的な直接法やサンドイッチELISA以外に、ELISAにはいくつかの方式が存在します:
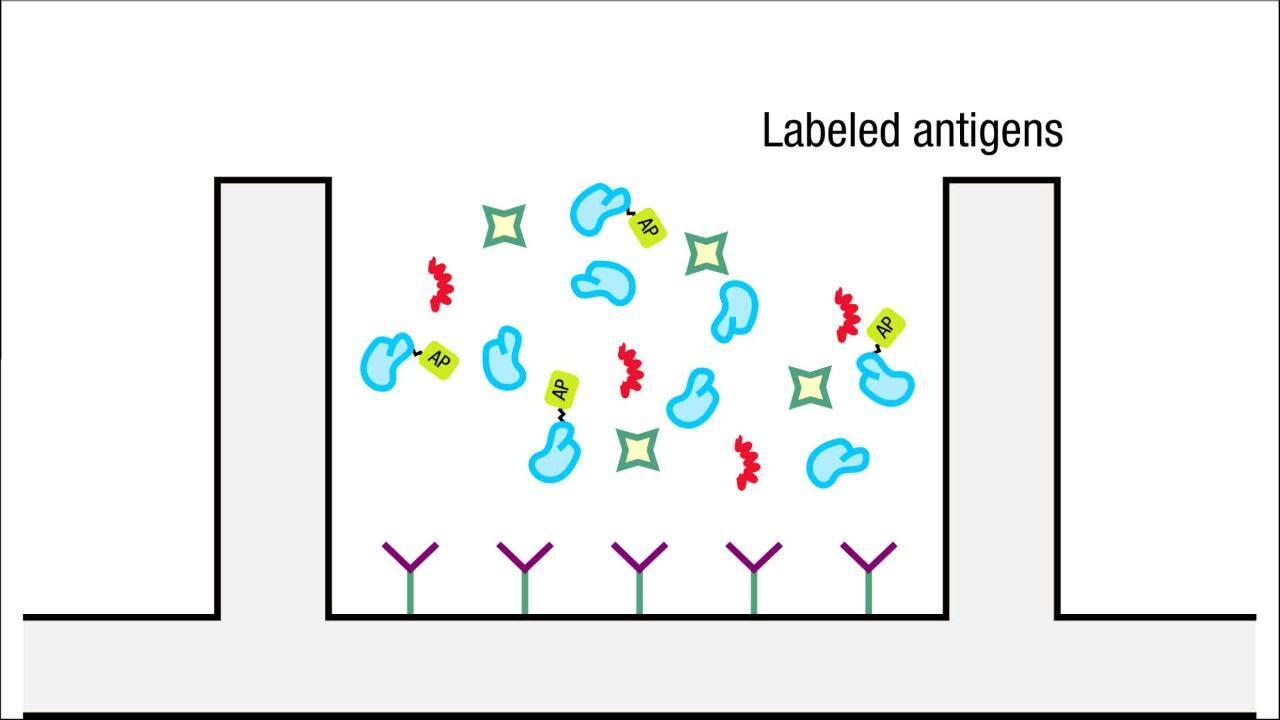
競合ELISAは、一般的に、サイズが小さいうえエピトープ(または抗体結合部位)をひとつしか有していない抗原に活用する戦略です。この手法では、抗体ではなく、精製抗原を標識対象として選択する方式もあります。サンプル由来の非標識抗原と標識抗原は、互いに競合しながら捕捉抗体へ結合します。アッセイウェルを標識抗原単独に比較して、精製抗原からのシグナルが低下した場合、サンプル中に抗原が存在することが示されます。
以下の動画では、競合ELISAについてご紹介いたします
ELISPOT(酵素結合免疫アッセイ):PVDF膜に支持されたマイクロプレートウェルに播種された細胞により分泌されたタンパク質に対する、ELISAに類似した捕獲法および測定法を指します。この「サンドイッチ」アッセイでは、タンパク質は播種細胞により分泌されながら局所的に捕捉され、また沈殿基質を用いた検出が行われます。ELISPOTは、膜表面上に斑点が現れるという点で、ウェスタンブロッティングに類似しています。
細胞内ELISA標準マイクロプレートに播種したうえで一晩培養した細胞を用いて実行します。培養細胞を固定化、透過および遮断した後、抗体を用いて標的タンパク質を検出します。この手法はサンドイッチアッセイではなく、間接アッセイです。二次抗体には、蛍光標識(蛍光プレートリーダーや顕微鏡による直接測定用)、または酵素標識(プレートリーダーによる水溶性基質の検出用)のいずれかが施されています。
通常、ELISAの実行時には、96ウェル(または384ウェル)のポリスチレンプレートと、溶液(生物学的液体、培養液または細胞可溶化物)中のサンプルを用います。以下、本ページではこのプラットフォームに関してご説明いたします。
使用準備の整ったReady-to-use ELISAキット
以下、本ページでは各コンポーネントとELISA法の一般原則についてご説明いたします。また、一般的に研究関心の対象とされる、多数のサイトカイン、神経生物学の分析対象物およびリン酸化タンパク質を検出する用途に、既製のサンドイッチELISAキットが市販されています。
様々な標的に対応したキットには、以下2種類のパッケージ仕様があります:
- ELISAキットには、コーティング処理済み抗体プレート、検出抗体、バッファ、希釈剤、標準書、基質が含まれています。
- Antibody Pair Kitsには、マッチ抗体と標準のみが含まれます(プレートや検出試薬は付属しません)。
詳細情報
Please Configure List Items!対象製品
Please Configure List Items!The revised Assay Development Technical Handbook is an essential resource for any laboratory using enzyme-linked immunosorbent assay (ELISA) and related plate-based assay methods. The handbook describes the essential techniques and tools for designing and optimizing ELISA Assays. Featured products include coated microplates, standards, blockers, buffers, probe-labeling reagents, secondary antibodies and detection substrates.
Contents include: Introduction to ELISA, Selecting an ELISA Plate, Thermo Scientific Pierce Microplates, Thermo Scientific Pierce Coated Microplates, Blocking and Washing, Blocking and Washing Reagents, Detection Probes, Antibody Labeling, Choosing a Substrate, Bulk and Custom Offerings, and Recommended Reading.
ELISAプレートの選択とコーティング処理
特定抗原に対して新たにELISAを展開する場合、まず初めに、抗原または捕捉抗体のプレートコーティング条件を最適化します。まず、最小タンパク質結合容量400 ng/cm²のマイクロアッセイプレート(組織培養処理プレートではなく)を選択します。ウェルとプレートの各アッセイ結果で一致すべきCV値の偏差を最小限に抑えるため、タンパク質結合のCV値(変動係数)を低く(5%未満推奨)抑えることも重要となります。検出するシグナルによって、プレートカラーを選択します。透明のポリスチレン製平底プレートは比色シグナル用、また黒色や白色の不透明プレートは蛍光シグナルおよび化学発光シグナル用となります。使用前に、視覚的にプラスチックの欠陥や傷などのプレート検査をすると、開発したアッセイからのデータ取得の際の収差の原因となります。
アッセイマイクロプレートのプラスチックへタンパク質が受動的吸着することによって、プレートにコーティングが施されます。このコーティング処理は、プラスチックと非極性タンパク質残基との疎水性相互作用により発生します。各タンパク質を最適に結合させるには、特殊条件や前処理が必要な場合がありますが、最も標準的なプレートのコーティング法では、リン酸緩衝食塩水(pH7.4)または炭酸-重炭酸緩衝液(pH9.4)などの、アルカリ性緩衝液中に溶解した2-10 μg/mlのタンパク質溶液を添加します。4~37℃で数時間から一晩インキュベートさせるためプレートを放置しておきます。コーティング溶液を除去した後、通常はブロッキングバッファを添加して、プラスチックウェル表面の余剰の結合可能部を適切に包含させます(以下の説明をご参照ください)。コーティングされたプレートを即座に使用開始できるか、あるいは乾燥させて4℃での保存後に使用可能な状態となるかは、コーティングされたタンパク質の安定性によって異なります。
最適なコーティング条件は各タンパク質によって異なる場合がありますので、ご注意ください。競合ELISA法以外では、プレートは、検出の有効範囲を最大限に高めるため、アッセイ中の実際の結合可能量より多くの捕獲タンパク質でコーティングされています。特に抗体をはじめとしたタンパク質は、後続工程において「フック効果」と呼ばれる現象による非特異的結合を防ぐために、最大結合容量よりも低濃度で最適にプレートへコーティングされます。非結合タンパク質が効果的に洗浄と除去されるのを妨害する各コーティングタンパク質の間に、タンパク質が閉じ込められる結果として、フック効果が発生します。フック効果により検出一次抗体と検出二次抗体が非特異的に捕捉される場合、バックグラウンドシグナルが高くなるため、シグナル対ノイズ比すなわちアッセイ感度が低減します。
対象製品
Please Configure List Items!コーティング済みのELISA用プレート
抗体やタンパク質の用途には、通例は受動的吸着によりコーティングされたプレートが適しています。しかし受動的吸着により、「配向性が不適当、変性を有する、固定化効率が悪い、標的分子と共に汚染物質へ結合する」といった問題点が生じる可能性があります。プロテインA、G、またはA / Gのコーティングされたプレートを用いれば、Fc領域を介してマイクロプレートに抗体を付着させられるため、適切に抗体を配向させ、抗原結合能力を保持させることができます。グルタチオン、金属キレート、または捕捉抗体がコーティングされたプレートを用いると、融合タンパク質を適切な配向でマイクロプレートに付着させることができます。主に受動的吸着では有効に結合しないペプチドや小分子類は、ビオチン化させ、ストレプトアビジンやニュートラタンパク質がコーティングされたプレートへ高効率で結合させることができます。また、ビオチン化抗体は、ビオチン結合タンパク質でコーティングされたプレート上に固定化させることができます。このように予めコーティングされたプレートを使用すると、変性効果を防止できるために、プレート表面から抗原や捕捉抗体を物理的に分離します。
対象製品
Please Configure List Items!ELISA用の抗体とプローブ
サンドイッチELISAシステムでは、捕捉抗体や検出抗体として、モノクローナル抗体またはポリクローナル抗体のいずれも使用が可能です。モノクローナル抗体は、抗原の微差を的確に検出と定量化ができる単一エピトープに対して単特異性を有しています。ポリクローナルは、極力多くの抗原をプルダウンする捕捉抗体として、頻繁に利用されています。また、モノクローナルは、サンドイッチアッセイにおいて特異性を向上させるため、検出抗体として利用されています。
サンドイッチELISAを設計する際、捕捉抗体と検出抗体が別箇の2つの非重複エピトープをそれぞれ認識しなければならないことに特に注意する必要があります。検出抗体に認識されるエピトープが不明瞭または変性状態であると、抗原が捕捉抗体へ有効に結合しません。相互干渉せず同時結合が可能な捕捉抗体および検出抗体は、「マッチドペア」と呼ばれ、サンドイッチELISA開発の用途に適しています。エピトープ情報や、マッチドペアとしてELISAで検証済みの抗体ペアに関する表示は、通例一次抗体の販売元から入手できます。
また、ELISAの設計にあたり抗体を選択する際は、費用の面も考慮しなければなりません。通常、ポリクローナル抗体の生成は、モノクローナル抗体よりも(約5分の1まで)安価に行えます。捕捉抗体および検出抗体にモノクローナル抗体を用いた場合に得られる特異性は、これら2つのモノクローナル抗体の産生費用や所要時間と照らし合わせて検討する必要があります。捕捉と検出に同一の抗体が用いられる「単サンドイッチ法」ELISAアッセイでは、ダイナミックレンジとELISAの最終感度が制限されることがあります。
詳細情報
Please Configure List Items!対象製品
Please Configure List Items!ブロッキングバッファと洗浄バッファ
マイクロプレートウェルの結合容量は、原則的には各ウェルにコーティングされたタンパク質量よりも高くなります。後続工程で抗体やタンパク質類がプレートに吸着しないように、未結合の表面域を遮断する必要があります。ブロッキングバッファは、無関係なタンパク質、タンパク質混合物、または化合物類から成る溶液であり、未結合の表面域全体へ受動的に吸着します。有効なブロッキングバッファとは、バックグラウンドシグナルを低減させ、シグナル対ノイズ比を改善することによって、アッセイ感度を向上させることが条件となります。理想的なブロッキングバッファは、非特異的相互作用の潜在的部位の全域に結合し、抗体結合のエピトープを変性や不明瞭化させずに、バックグラウンドを完全に排除します。
新たにELISAを開発する際、アッセイにおいて高いシグナル対ノイズ比を実現するため、数種類のブロッカー試験を行うことが重要です。非特異的結合は、使用されるサンプルや抗体に固有なタンパク質どうしの各種相互作用など、多数の要因から影響を受けます。ブロッカー選択の際の最も重要な要因となるシグナル対ノイズ比は、標的分析物を含有しないサンプル由来のシグナルに対して、標的分析物を含有したサンプル由来のシグナルの比較値として測定されます。ブロッカー使用分量が不十分であると、バックグラウンド過剰やシグナル対ノイズ比低下につながります。過剰濃度のブロッカーを用いると、 抗体-抗原相互作用の遮蔽や、酵素の阻害を起こすことがあり、前述のようにシグナル対ノイズ比の低下につながります。単一ブロッキング剤の使用は、どのような理由があろうとも推奨されません。適正にブロッキング工程を最適化させるには、実験的テストを行うことが不可欠となります。
ブロッキングだけでなく、ELISAの各工程後の洗浄も必須となります。非結合試薬を除去し、バックグラウンドを低減させ、さらにシグナル対ノイズ比を向上させるには、洗浄工程が不可欠です。洗浄が不十分な場合、バックグラウンドが高くなります。とはいえ、逆に過度に洗浄を行うと、ウェルから抗体や抗原が溶出して感度が低下する原因となります。洗浄は、トリス緩衝食塩水(TBS)または添加剤非含有のリン酸緩衝生理食塩水(PBS)などの生理的バッファ中で行います。一般的には、Tween-20(0.05%)などの界面活性剤をバッファへ添加して、非特異的結合した物質の除去を促進させます。また、何らかの添加された界面活性剤と共に、ブロッキングバッファ希釈溶液を使用するという、標準的手法をとることもできます。洗浄バッファ中にブロッキング剤や界面活性剤を添加すると、アッセイ中のバックグラウンドの低減が促進されます。高純度の界面活性剤を使用して、酵素阻害剤や過酸化物などのアッセイ妨害不純物の導入を防ぐと、最良の結果が得られます。
詳細情報
Please Configure List Items!対象製品
Please Configure List Items!ELISAの検出戦略
ELISAシステムの最終段階では、必ず検出工程を実行します。この工程では、放射性タグまたは蛍光タグが使用されない限り、酵素基質の導入を行います。酵素の作用により、基質は検出可能な生成物へ転換されます。適切に構築・開発されたELISAでは、基質添加時に生成されるシグナル強度は、プレートに捕捉され検出試薬により結合した抗原量に正比例します。酵素標識抗体(特に、西洋ワサビペルオキシダーゼ、HRPを含有する抗体)は、発色性、化学蛍光性および化学発光性のイメージング用に種々の基質を利用できるため、ELISAの検出や実証において柔軟性が非常に高くなります。
発色性ELISA基質は、蛍光性や化学発光性の基質ほど高感度性はありませんが、直接の可視化ができ、動態試験の実行が可能になります。また、多数のラボに共通の標準型吸光度プレートリーダーを用いて、発色性ELISA基質を検出することができます。蛍光性ELISA基質は、それほど普及しておらず、蛍光性タグからシグナル放出を発生させるには、適切な励起ビームを生成する蛍光光度計が必要になります。化学発光性基質は、照度計プレートリーダーを使用することが推奨されますが、 デジタルカメラシステムなどの様々な手段で検出が可能です。ELISAで化学発光性基質を使用すると、シグナル強度値が、他の基質よりも大きく変動するという欠点があります。多数のプレートリーディングを必要とするアッセイにおいて、プレートの読み込み前にシグナルが減衰し始めた場合、この基質は問題を誘発することがあります。したがって、サンプル中のシグナル減衰を低抗原量として誤認識しないように、アッセイを基質に最適化させることが重要です。
詳細情報
Please Configure List Items!For Research Use Only. Not for use in diagnostic procedures.