Search Thermo Fisher Scientific

成像效果更优的流式细胞仪,可将形态学分析和流式细胞数据分析结合一起
- 屡获殊荣的 Invitrogen Attune CytPix 成像型流式细胞仪将声波聚焦与高速明场相机相结合,能够同时进行高通量的流式细胞分析和高分辨率的明场成像 。
- 使用 Attune 流式细胞仪软件进行自动图像分析 ,可将事件特征转换为独特的形态参数,并可与标准荧光和散射参数结合使用。
Attune CytPix 成像型流式细胞仪荣获医疗技术类 2003 年爱迪生奖™ 。Edison Awards 是广受赞誉的奖项,旨在表彰在新产品和服务开发、设计和创新方面的出色表现。
声波聚焦技术可实现快速明场成像
在 Attune CytPix 流式细胞仪上采集样本时,高速明场相机可采集并储存检测到的事件图像,每秒可多达6000张,具体取决于流速和图像大小。为实现更高灵活性,可使用 Attune 流式细胞仪软件按需调整图像采集频率,并根据需要选择特定的设门以进行图像采集。声波聚焦有助于定位细胞,从而获得清晰的细胞图像。
声波聚焦使得细胞处于良好成像位置
没有采用声波聚焦技术(左)时,微球没有聚集在中心位置且经常模糊不清。声波聚焦(右)可减少横向位置变异、时间变异和景深限制,从而可获得清晰的图像。
形态参数的自动图像分析
Attune 流式细胞仪软件 使用经过白细胞和微球预培训的模型,通过自动图像分析功能得出形态参数。该软件能够以每秒高达1,000幅图像的速率进行图像分析,并且可由用户在软件后台运行的进程队列中进行管理。这些基于图像的扩展参数提供了数据,使用户能够通过细胞计数(颗粒计数)和形态学特征(如圆形度 [圆度]、大小 [面积]、形状 [偏心率] 和复杂性 [熵])来确认单体。 对这些扩展参数设门后,您可以快速、准确地鉴别感兴趣的细胞群,从而在不需要手动审查或仅需少量手动审查的情况下确认设门策略。
成像型流式细胞术的应用领域
单个事件的图像和衍生的形态学数据可以帮助大量几乎无限的流式细胞术应用。功能范围包括:
可视化并区分偶合事件与细胞间相互作用。
使用高通量、详细的图像验证
使用 Attune 流式细胞仪软件6.0的图像分析功能
通过向细胞培养 QC 工作流程中加入快速成像结果,从而快速检测质量问题
优化设门策略。即使是稳健的手动单体设门也容易出错,因此它仍是几乎所有流式细胞分析测定的主观决策点。成像结果有助于确认和调整设门,以便只圈出单个目的细胞。
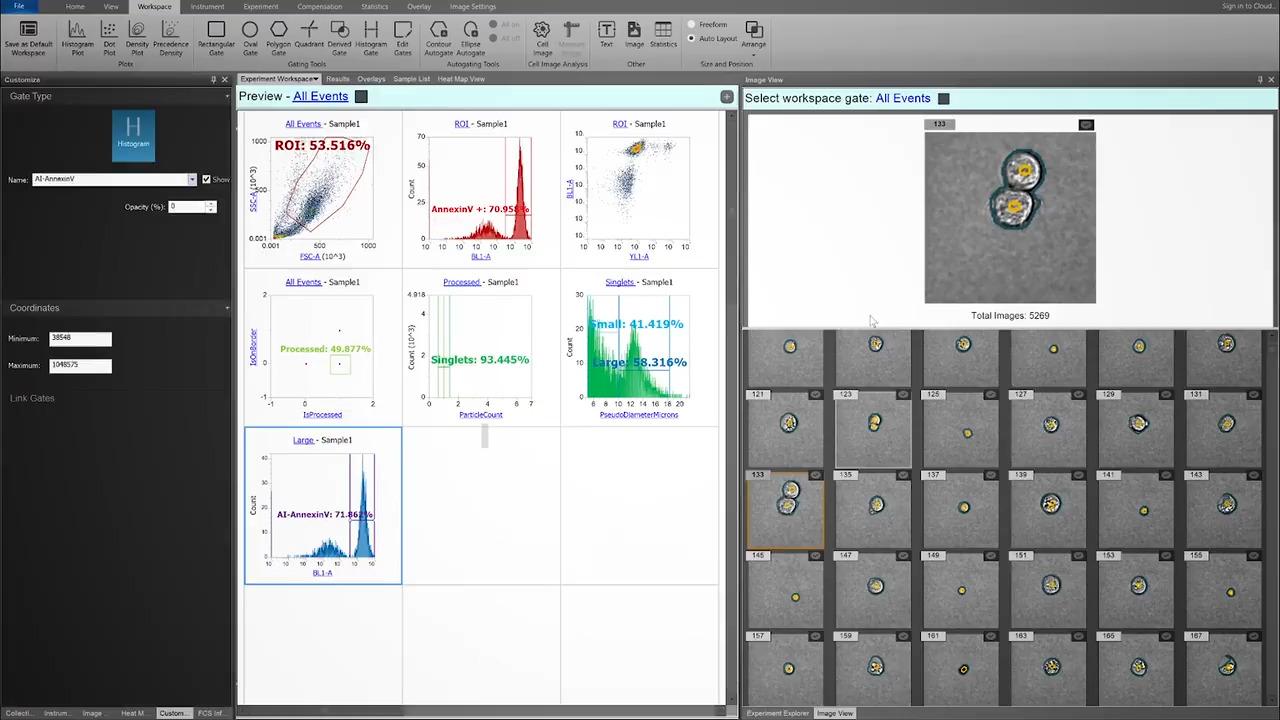
在此,一名有经验的用户已自信地为单体设门。 在评估手动单体门后,源自 CytPix 图像的参数 ParticleCount 显示此门包含超过 4% 的聚合体。
也许更重要的是,这些事件含有表型明显不同的细胞, 这可导致对双阳性事件(特别是在稀有细胞群中)做出错误结论。
细胞培养质控。在质量控制(QC)工作流程中增加快速成像可在早期阶段发现和追踪细胞培养相关问题。例如,在某实验室中,在对 Ramos(淋巴瘤)细胞培养进行常规传代检查时观察到,尽管看起来是在融合,但细胞计数和存活率减少。进一步检测发现存在大量微生物污染,但这是从何时何处开始的?
由于该细胞系之前已经在Attune CytPix 成像型流式细胞仪上进行了分析,研究人员重新打开图像,发现至少五天前就记录了微生物感染。当时,污染早期的迹象被误认为碎片,但回顾性研究证实培养物中存在具有相同特征的问题细胞。追踪感染帮助实验室建立了额外的实验室规程,以筛选和保护对实验具有关键性作用的细胞系。
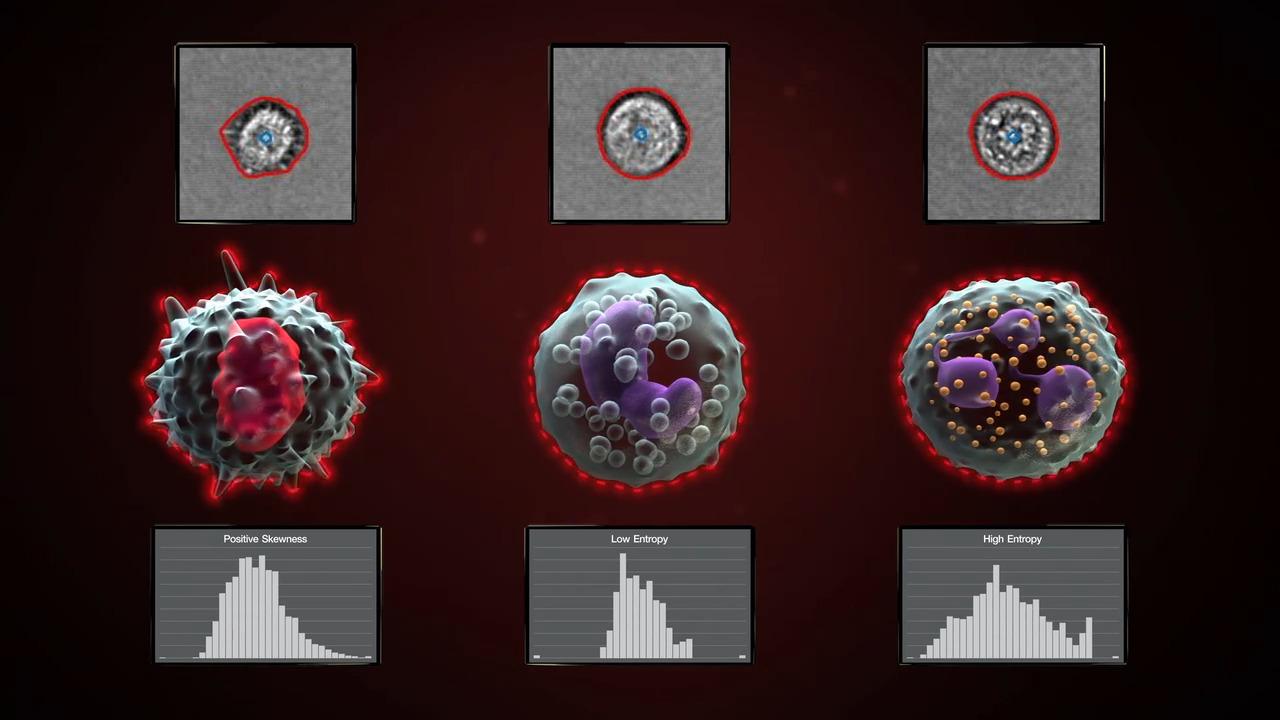
表征细胞群。图像中的形态学信息增加了流式细胞数据的丰度。 例如,图中显示了使用 Annexin V 和 PI 的常规细胞凋亡测定,添加了细胞成像以表征每个细胞群中的细胞,从而显示不同形态特征。如果仅通过流式染色分析无法获取该形态变化的信息。
分析细胞间相互作用。图像甚至能显示出细胞间的相互作用。 图中,经过基因改造的 CAR T 免疫细胞与 Ramos(淋巴瘤)细胞共同培养后进行染色,在 Attune CytPix 成像型流式细胞仪上进行采集和成像分析。第二象限的图像(两种染料均为阳性,作为单个事件采集)显示 CAR T 细胞对靶向 Ramos 细胞具有明显的杀伤作用,提供了改造后细胞具有功能的确切证据。
我们之前展示了拍摄 CAR-T/Ramos 细胞相互作用图像的能力。现在我们来看看最感兴趣的细胞群—双阳性事件,以了解更多信息。现在我们可以使用源自图像的扩展参数(圆度与强度偏斜度)来进一步检查这些细胞群的特征并改进这些事件的设门,从而提高数据稳健性。在此,通过使用 基于图像的定量参数的设门策略,我们可区分相互作用细胞与偶合事件,从而更准确地分析相互作用细胞。
发现分析机会
利用Attune CytPix 成像型流式细胞仪对细胞进行反向设门,基于图像形态可能发现更多感兴趣的细胞亚群,而传统流式数据无法提供这些信息。
例如,大肠杆菌细胞可培养为两种菌落形成单位 (CFU): 类似于单细胞的短 CFU,以及带不完全裂变环的加长结构,代表在每个近似细胞长度处不完全缢缩。传统单个细胞门(SSC-A/SSC-H)和荧光信号门(SSC/核染色)均无法区分这些细胞群。但通过 Attune CytPix 成像型流式细胞仪,可以查看和分类图像信息,并根据其形态特征为不同 CFU 类型进行设门。
两种大肠杆菌 CFU 类型的区分。大肠杆菌在 37ºC 条件下培养过夜,然后在 4ºC 条件下继续培养3天。使用 Attune CytPix 流式细胞仪以 100 μL/分钟的流速进行样本数据采集。可以从这些图像鉴别两类 CFU:(A) 代表单细胞的短菌落和 (B) 带不完全裂变环的加长结构。各亚群细菌的典型图像如图所示。对所选图像反向设门显示两个亚群在 FSC/SSC 点图上完全不同(橙色点,左)。
视频和演示
For Research Use Only. Not for use in diagnostic procedures.