Search Thermo Fisher Scientific
ELISAの開発および最適化
ELISAの開発
ELISAの開発において、考慮すべき点が数多くあります。最初に、使用するELISA方式(直接法、間接法、またはサンドイッチ法)を選びます;。各方式によって、標的抗原の捕捉と検出の手段が異なります。ELISAの直接法および間接法では、まずアッセイプレート上に抗原を固定化させます。その後、直接法では標識一次抗体を用いて、また間接法では一次抗体と標識二次抗体を用いて、それぞれ抗原の検出を行います。ELISAサンドイッチ法は最も堅牢な方式とみなされています。その理由は、抗原が二つの一次抗体間で「サンドイッチ」(捕捉および検出)され、その後標識二次抗体を用いて検出される(検出抗体がビオチン化されている場合は、標識ストレプトアビジンを用いて検出される)ことによります。
以下の各動画は、サンドイッチELISAの検出法、および競合ELISAと呼ばれる全く異なるELISA方式についてご紹介します。
各種ELISA方式によって、特異性、感度、単純性、および所要時間(つまり工程数)が異なります。また、それぞれ必要な成分数や変種数が異なります。例えばサンドイッチELISA法では、特異的抗体の相互適合性ペア(いわゆる抗体のマッチドペア)を必要とします。研究者自身によって一からELISA開発が行われるケースの大半は、目的の標的が「新規」であり、マッチドペア抗体が利用できない理由によるものです。新たな抗体産生が求められる場合があります。
ELISA方式やELISAの各コンポーネント(例:マイクロプレート、洗浄バッファー、ブロッキングバッファー、サンプル希釈液、酵素複合体、および基質)の詳細については、「ELISAに関する概要」や、弊社のテクニカルガイド(またはテクニカルハンドブック)をご覧ください。
特殊研究ニーズのために新たなELISA開発の必要性がない限り、通常は市販の各ELISAキットを確認しながら目的の標的に対応した製品お探しください。標的の特異的検出に最適化されたReady-to-useのELISAキットを1,000種類以上も取り揃えております。キットには、抗体コーティング済みのプレート、およびアッセイ実行に必要なコンポーネントが含まれています。各キットは検証および品質検査を通過しているため、手間のかかる最適化工程(後述)を実行する必要はありません。
The revised Assay Development Technical Handbook is an essential resource for any laboratory using enzyme-linked immunosorbent assay (ELISA) and related plate-based assay methods. The handbook describes the essential techniques and tools for designing and optimizing ELISA Assays. Featured products include coated microplates, standards, blockers, buffers, probe-labeling reagents, secondary antibodies and detection substrates.
Contents include: Introduction to ELISA, Selecting an ELISA Plate, Thermo Scientific Pierce Microplates, Thermo Scientific Pierce Coated Microplates, Blocking and Washing, Blocking and Washing Reagents, Detection Probes, Antibody Labeling, Choosing a Substrate, Bulk and Custom Offerings, and Recommended Reading.
ELISAの最適化
実用的なELISAが開発された後に、最適化手順を実行してパフォーマンスを向上させることができます。アッセイの各コンポーネントの最適化手順については、以下の各タブをクリックしてください(抗体捕捉から酵素複合体、さらに基質の選択まで網羅しています)。これらの工程は、ELISAサンドイッチ法の使用を前提としています。
最適化手順では、抗体・サンプル・バッファーなどを種々の濃度(希釈度)で試験することが非常に重要です。各成分は別々に記載されていますが、大半のケースではチェッカーボード滴定によって、2種類の成分を同時に最適化可能です(図1参照)。

- 種々濃度の捕捉抗体を含むコーティングバッファー中を調製します(下表1の濃度範囲をご参照ください)。
- 各濃度の等容量をプレートへ添加て、ELISAを実行します。
- シグナルまたとバックグラウンドを確認します。
| 詳細情報 | 対象製品 | ||
- 種々のブロッキング溶液を調製します。ブロッキング溶液が準備されていない場合(BSAなどの単一タンパク質である場合)、別の濃度のタンパク質を試験してください。
- それぞれ等容量をプレートへ添加て、ELISAを実行します。
- シグナルとバックグラウンドを確認します。
| 詳細情報 | 対象製品 | ||
- サンプルのマトリックスに極力近い標準希釈液を調製してください。マトリックスを正確に再現できない場合には、別の標準希釈溶液をテストしてください。
- それぞれ等容量をプレートへ添加て、ELISAを実行します。
- 標準曲線で適切なダイナミックレンジを確認し、サンプルの希釈直線を確認してください。
- 標準曲線のダイナミックレンジが狭い場合、別の希釈液を使用しなければならない可能性があります。希釈時のサンプルの希釈直線が優れない場合、サンプルマトリックスと標準希釈液が適していない可能性があります。こうした場合には、スパイク回復または希釈直線試験を行ってください。
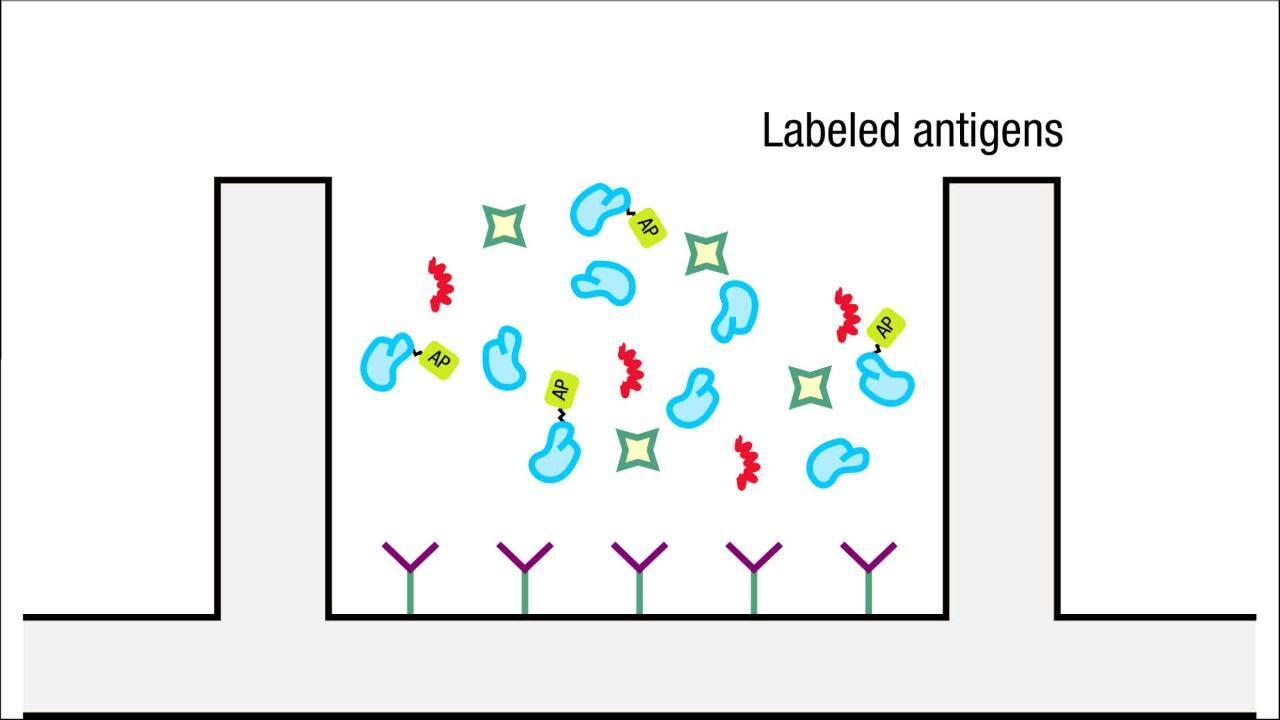
- 種々濃度の検出抗体を含む標準希釈液を調製します(下表1の濃度範囲をご参照ください)。
- 各濃度の等容量をプレートへ添加し、ELISAを実行します。
- シグナルとバックグラウンドを確認します。
| 詳細情報 | 対象製品 | ||
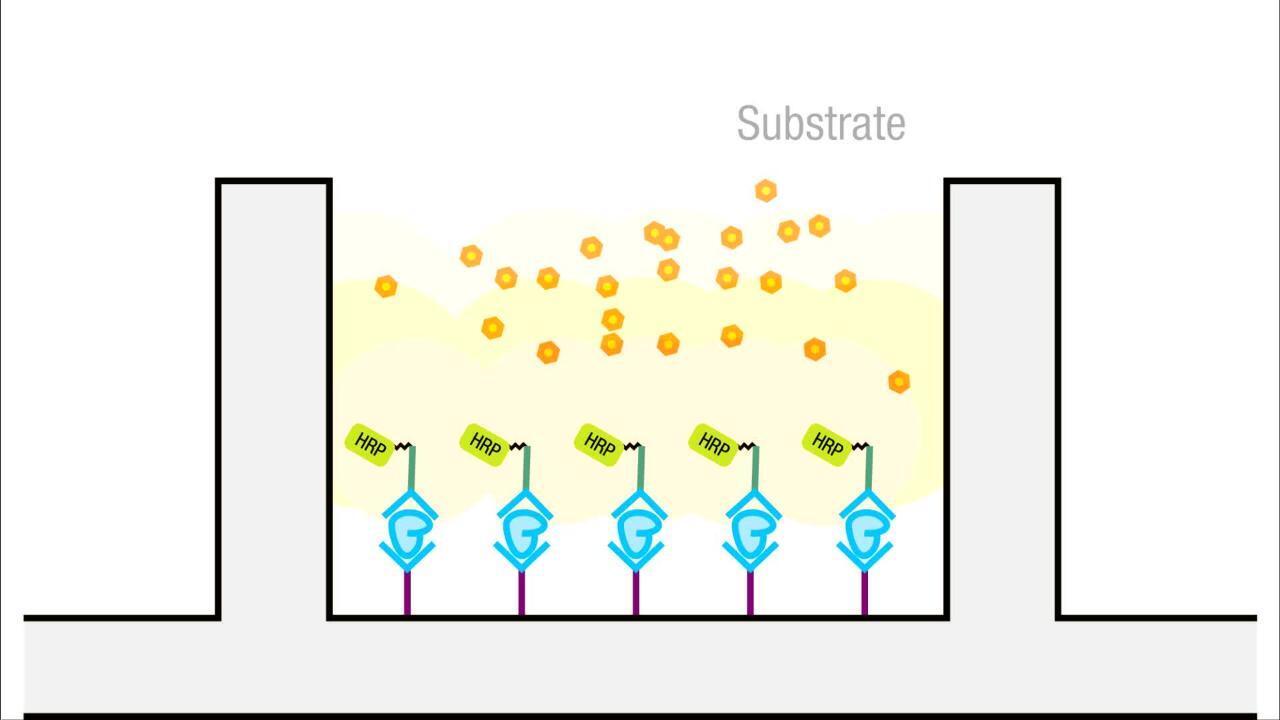
- 表2中の濃度範囲に応じて、種々濃度の酵素複合体を含む標準希釈液中を調製します。各基質に対する濃度範囲内の濃度に設定してください。
- 各濃度の等容量をプレートへ添加して、ELISAプロトコルを実行します。
- シグナルとバックグラウンドを確認します。
- サンプル中の抗原想定量や、使用機器による抗原検出能力に基づいて、基質を選択してください。
- 作業溶液をプレートへ添加して、ELISAを実行します。
- 抗原が全ダイナミックレンジにわたり確実に検出可能な場合、基質の使用は適切です。検出において抗原が閾値以下である場合は、より高感度な基質を選択してください。
- 表2中の濃度範囲で、種々濃度の酵素複合体を含む標準希釈液を調製します。各基質に対する濃度範囲に対応した濃度に設定してください。
- 各濃度の等容量をプレートへ添加して、ELISAプロトコルを実行します。
- シグナルとバックグラウンドを確認します。
| 供給源 | コーティング抗体 | 検出抗体 |
|---|---|---|
| ポリクローナル血清 | 5–15 µg/mL | 1–10 µg/mL |
| 未精製腹水 | 5–15 µg/mL | 1–10 µg/mL |
| アフィニティー精製済みポリクローナル抗体 | 1–12 µg/mL | 0.5–5 µg/mL |
| アフィニティー精製済みモノクローナル抗体 | 1–12 µg/mL | 0.5–5 µg/mL |
表2 ELISAにおける種々の系の酵素複合体の推奨濃度 酵素複合体によっては限定的な推奨濃度範囲が指定され事があるため、基質の説明書をご確認ください。
| 酵素 | 系 | 濃度 |
|---|---|---|
| HRP | 比色分析系 | 20–200 ng/mL |
| 化学蛍光系 | 25–50 ng/mL | |
| 化学発光系 | 10–100 ng/mL | |
| AP | 比色分析系 | 100–200 ng/mL |
| 化学発光系 | 40–200 ng/mL |
For Research Use Only. Not for use in diagnostic procedures.