Search Thermo Fisher Scientific

이미징이 향상된 유세포분석기를 통해 형태학 및 유속 데이터 분석을 결합하였습니다.
- Invitrogen Attune CytPix Flow Cytometer 유세포분석기는 Acoustic Focusing과 고속 brightfield 카메라를 결합하여 고처리량의 유세포분석과 고분해능의 brightfield 이미징을 동시에 실행할 수 있습니다.
- Attune 유세포분석 소프트웨어를 사용한 자동 이미지 분석은 이벤트 기능을 표준 형광 및 산란 파라미터와 결합할 수 있는 형상 측정 파라미터로 변환합니다.
Attune CytPix 유세포분석기는 Medtech 카테고리에서 2023년 Edison Awards ™ 수상 제품 중의 하나로 선정되었습니다. Edison Awards는 신제품 및 서비스 개발, 설계 및 혁신 분야에서 우수성을 기리는 가장 권위있는 상 중의 하나입니다.
Acoustic focusing은 빠른 brightfield 이미징을 가능하게 합니다.
Attune CytPix 유세포분석기에서 시료를 획득하면, 고속 brightfield 카메라가 유속과 이미지 크기에 따라 초당 최대 6,000개 이미지 속도로 검출된 이벤트의 이미지를 캡처하고 저장합니다. 유연성을 높이기 위해 Attune 유세포분석 소프트웨어를 사용하여 필요에 따라 이미지 캡쳐 빈도를 조정할 수 있고, 필요한 경우 이미지 캡처를 위한 특정 게이트를 선택할 수 있습니다. Acoustic focusing은 선명한 이미지를 얻을 수 있도록 세포를 배치하는 데 도움이 됩니다.
Acoustic focusing은 최적의 이미징을 위해 세포를 배치합니다.
Acoustic focusing이 없으면(왼쪽), 비드가 중심을 벗어나 흐릿한 경우가 많습니다. Acoustic focusing(오른쪽)은 선명한 이미지를 얻기 위해 측면 위치 변화, 시간 변동 및 심도 제한을 감소시킵니다.
형태학적 파라미터에 대한 자동 이미지 분석
Attune 유세포분석 소프트웨어는 백혈구와 비드에 대해 사전 훈련이 된 모델을 사용하여 형태학적 파라미터를 파생시킬 수 있는 자동 이미지 분석 기능을 제공합니다. 이 소프트웨어는 초당 최대 1,000개의 이미지 처리 속도로 이미지 분석을 자동화하며, 소프트웨어 백그라운드에서 실행되는 처리 대기열에서 사용자가 관리할 수 있습니다. 확장된 이미지 기반 파라미터는 세포 수(입자 수) 및 원진도(원형도), 크기(제곱면적), 모양(편심률), 복잡도(엔트로피) 등의 형태학적 기능을 사용하여 Singlet을 확인하기 위한 데이터를 제공합니다. 이와 같은 확장 파라미터를 게이팅하면 수동 검토를 거의, 혹은 전혀 하지 않고도 대상 집단을 빠르고 정확하게 식별하여 게이팅 전략을 확인할 수 있습니다.
이미징이 향상된 유세포분석 애플리케이션
개별 이벤트 및 파생된 형태학적 데이터의 이미지는 광범위하고 거의 무제한적인 유세포분석 응용 분야에 도움이 될 수 있습니다. 다음과 같은 기능이 있습니다.
이미지 기반 데이터를 사용하여 Doublet 및 Debris를 제외시키기 위해 게이트를 설정하고 이미지를 사용하여 게이트 정확도를 확인할 수 있습니다.
기존 흐름 프로토콜 내에서 형태학적으로 뚜렷이 구분되는 집단을 문서화하고 특성 분석할 수 있습니다.
세포간 상호작용에서 동시 발생 이벤트를 시각화하고 구별할 수 있습니다.
고처리량, 상세한 사진 증거를 사용할 수 있습니다.
Attune 유세포분석 소프트웨어 6.0의 이미지 분석 기능을 이용
세포 배양 QC 워크플로우에 신속한 이미징 기능을 추가하여 품질 문제를 신속하게 검출합니다.
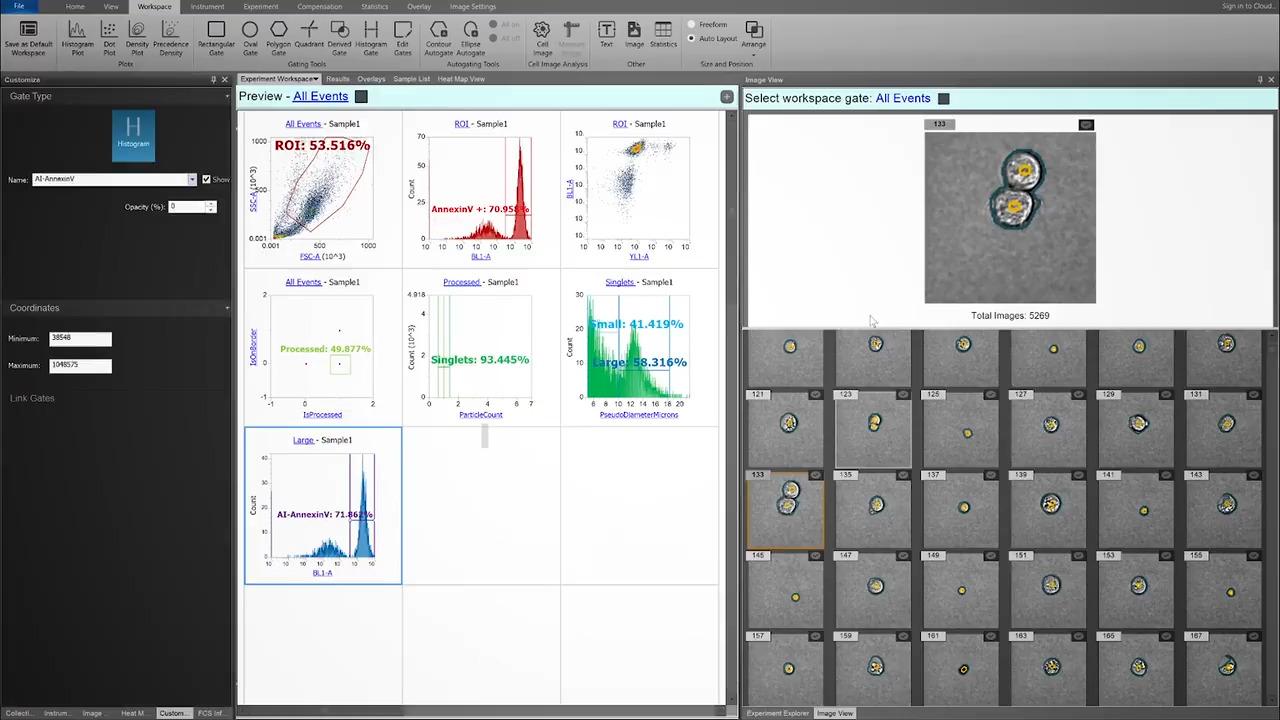
게이팅 전략 최적화 거의 대부분의 유세포분석에서 견고한 수동 Singlet 게이팅도 오류가 발생하기 쉽고 주관적인 판단에 의존하고 있습니다. 이미징을 관심 있는 단일 세포만 포함하도록 게이트를 확인하고 조정하는데 사용할 수 있습니다.
여기에서는 숙련된 사용자가 Singlet을 확실하게 게이팅했습니다. 수동 singlet 게이트를 평가한 결과, CytPix 이미지 파생 파라미터 ParticleCount는 이 게이트에 4%의 Aggregate가 포함되어 있음을 밝혔습니다.
가장 중요한 점은 해당 이벤트에는 분명히 그 밖의 표현형의 세포가 포함되어 있을 것이므로, 이중 양성 이벤트와 관련하여 잘못된 결론을 내렸을 가능성을 배제할 수 없다는 것입니다(특히 rare한 집단의 경우).
세포 배양 QC. 품질 관리(QC) 워크플로우에 신속한 이미징 기능을 추가하면 프로세스 초기에 세포 배양 문제를 검출하고 추적할 수 있습니다. 예를 들어, 한 실험실에서 Ramos(림프종) 세포 배양에 대한 일상적인 계대 검사는 융합으로 보이지만 세포 수와 생존율이 감소하는 것을 관찰하였습니다. 추가 조사를 통해 상당한 미생물 오염으로 밝혀졌는데, 언제 어디서 이러한 오염이 시작되었을까요?
이전에 세포주를 Attune CytPix 유세포분석기에서 분석했기 때문에 연구원들은 다시 이미지로 돌아가 최소 5일 전에 미생물 감염을 문서화할 수 있었습니다. 당시, 초기 징후는 Debris로 분석되었지만 후향적 평가는 배양물 중 문제가 있는 세포와 공통된 특징을 보였습니다. 감염을 추적함으로써 실험실에서 검사상 중요한 세포주의 스크리닝 및 보호를 위한 추가적인 실험실 절차를 정립하는 데 도움이 되었습니다.
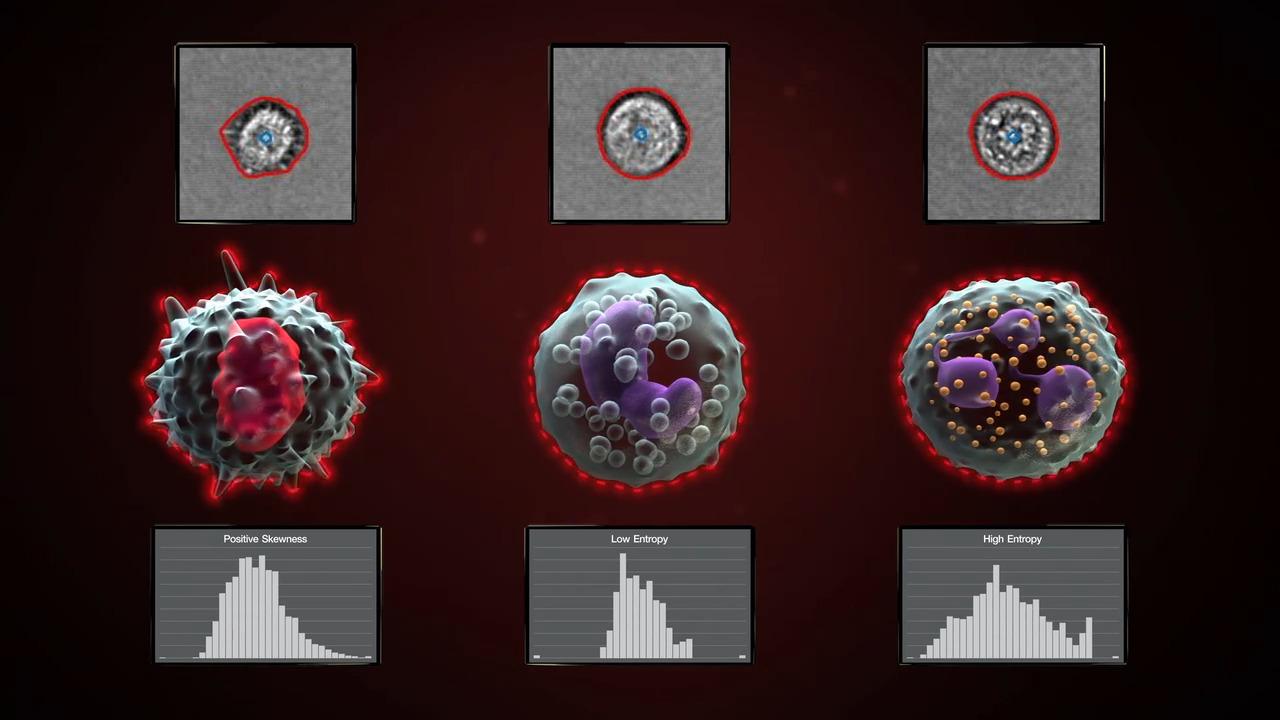
세포 집단 특성화. 이미지에서 얻은 형태학적 정보를 통해 유세포분석 데이터를 풍부하게 할 수 있습니다. 예를 들어 아래 그림은 Annexin V와 PI을 사용한 기존의 Apoptosis 분석을 보여주는데, 세포 이미징을 추가하여 각 집단에서 세포의 특징을 묘사해 형태학적으로 뚜렷이 구분되는 특징을 나타냅니다. 이러한 통찰은 멀티플렉스 염색만으로는 얻을 수 없었습니다.
세포간 상호작용의 분석. 이미징은 세포간의 상호작용을 보여줄수도 있습니다. 이 그림에서, 엔지니어링된 CAR T 면역치료 세포를 Ramos(림프종) 세포와 함께 인큐베이션하고 염색해서 획득한 후 Attune CytPix 유세포분석기에서 이미징하였습니다. 사분면의 Q2(두 가지 염색에서 모두 양성이고, 단일 이벤트로 획득됨)에서 얻은 이미지는 Ramos 세포를 시각적으로 타겟팅하는 CAR T 세포를 보여주며, 엔지니어링된 세포 효능에 대한 분명한 증거를 보여줍니다.
과거 CAR-T/Ramos 세포 상호작용 이미징의 힘을 입증한 바 있습니다. 가장 큰 관심을 모으고 있는 집단인 이중 양성 이벤트에 대해서 좀 더 알아보겠습니다. 이제 확장된 이미지 파생 파라미터(원형도 대 강도의 왜도)를 사용해 집단을 더욱 세분화하고 데이터의 견고성을 더욱 높일 수 있습니다. 여기서는 이미지 파생 파라미터를 사용함으로써 세포간 상호작용과 동시 발생 이벤트를 보다 정확하게 구분할 수 있음을 보여 줍니다.
분석 기회 발견
또한 Attune CytPix 유세포분석기에서 백게이팅 영상화된 세포를 통해 형태학적 특징을 사용하여 유세포분석 데이터만으로는 명확히 드러나지 않는 흥미로운 하위집단을 발견할 수 있습니다.
예를 들어, E. coli 세포의 배양은 시간이 지남에 따라 두 가지 유형의 콜로니 형성 단위(CFU)로 발전합니다. 두 가지 유형은 단일 세포와 유사한 짧은 CFU와 각각의 세포 길이에서 불완전한 수축을 나타내는 불완전한 분열 고리가 있는 길쭉한 구조입니다. 기존의 단일 세포 게이트(SSC-A vs SSC-H) 또는 형광 게이트(SSC vs nucleated stain)으로는 이러한 집단을 충분히 분리할 수 없습니다. 그러나 이미징 기능이 향상된 Attune CytPix 유세포분석기를 사용하면 이미지를 보고 그룹화한 다음 형태학적 특성에 따라 CFU 유형을 파악할 수 있습니다.
두 가지 E. coli CFU 유형의 차이. E. coli 세포를 밤새도록 37ºC에서 배양한 후 4ºC에서 3일간 배양했습니다. 100 µL/min으로 Attune CytPix 유세포분석기에서 시료를 수집하였습니다. 이미지에서 두 가지 유형의 CFU가 확인되었습니다. (A) 단일 세포와 유사한 짧은 콜로니와 (B) 불완전 분열 링을 가진 긴 구조. 각 집단의 대표 이미지를 표시하였습니다. 선택된 이미지에서의 백게이팅은 두 집단이 FSC vs SSC Dot plot(주황색 점, 왼쪽)에서 차이가 있음을 보여주었습니다.
동영상 및 데모
For Research Use Only. Not for use in diagnostic procedures.