Search Thermo Fisher Scientific

イメージングが強化されたフローサイトメーターは形態学とフローのデータ解析の組み合わせを可能にします
- 受賞歴にあるInvitrogen Attune CytPix Flow Cytometersは、アコースティックフォーカシングと高速明視野カメラを組み合わせており、ハイスループットのフローサイトメトリーと高解像度明視野イメージングを同時に実現します。
- Attune Cytometric Softwareを使用した自動画像解析は、イベントの特性を特徴的な形態測定パラメーターに変換し、標準的な蛍光パラメーターや散乱パラメーターと組み合わせることができます。
Attune CytPixフローサイトメーターは2023 Edison Awards™をMedtechカテゴリーで受賞しました。Edison Awardsは、新製品やサービスの開発、デザイン、およびイノベーションの卓越性を称える、もっとも名誉ある賞の1つです。
アコースティックフォーカシングは迅速な明視野イメージングを可能にしました
サンプルをAttune CytPixフローサイトメーターで取得すると、検出したイベントの画像を高速明視野カメラが取得し保存します。その速度はフロー速度と画像サイズによりますが、1秒あたり最大6,000画像です。Attune Cytometricソフトウエア使用すると、必要に応じて画像の取得頻度を調整したり、要件によって画像取得に特定のゲートを選択できるため、柔軟性が向上します。アコースティックフォーカシングは、シャープな画像が得られるように細胞を配置するのに役立ちます。
アコースティックフォーカシングで細胞を配置して最適なイメージングを実現
アコースティックフォーカシングなしの場合(左)、 ビーズが中心を外れてしまい、ぼやけて見えることがよくあります。アコースティックフォーカシング(右)は、横方向の位置変動、時間的変動、および視野の限界を低減し、鮮明な画像を取得します。
形態測定パラメーターの自動画像解析
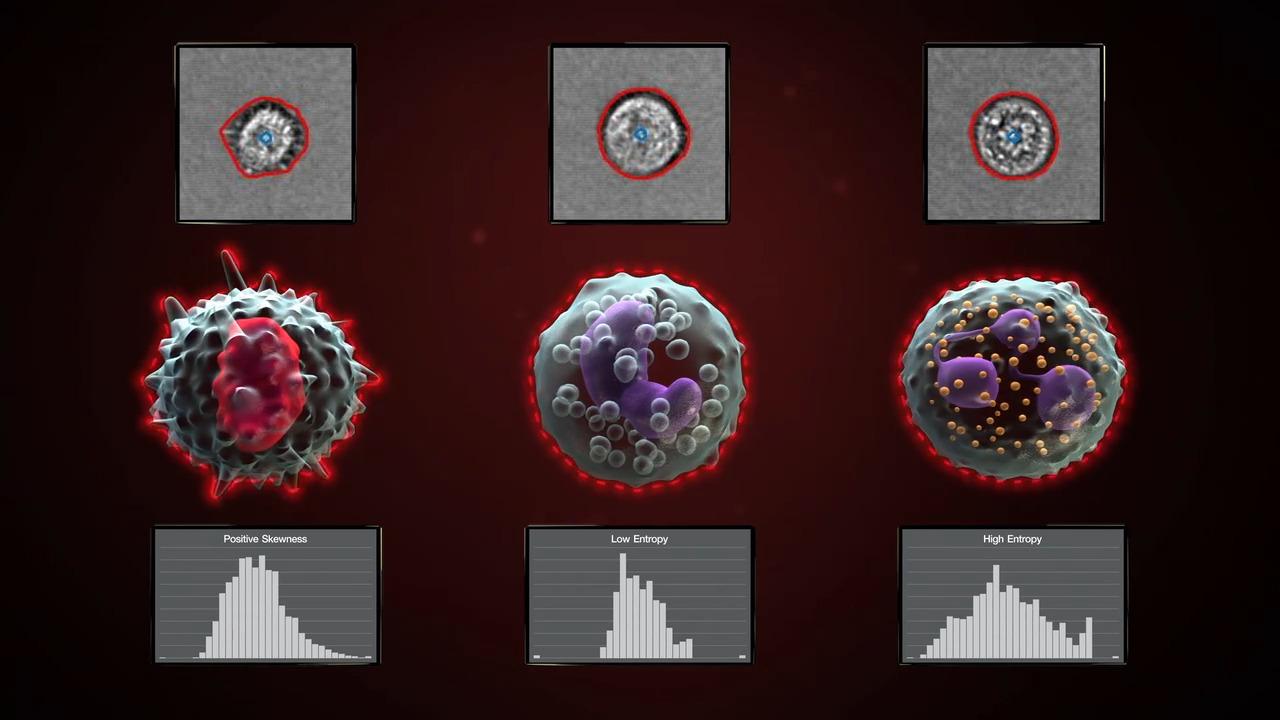
Attune Cytometricソフトウエアは、白血球やビーズで事前トにレーニングされたモデルを使用して形態測定パラメーターを抽出する自動画像解析機能を備えています。このソフトウエアは最大1,000画像/秒の速度で画像を処理し、ユーザーは、ソフトウエアのバックグラウンドで実行する処理キューを管理できます。この拡張された画像ベースのパラメーターは、細胞数(粒子数)や、円形度(真円度)、サイズ(面積平方)、形状(偏心度)、複雑さ(エントロピー)などの形態特性によりシングレットを確認できるデータを提供します。これらの拡張パラメーターでゲーティングを行うことで、目的の集団を迅速かつ正確に特定し、手動でほとんどチェックすることなくゲーティングストラテジーを確認できます。
イメージングが強化されたフローサイトメトリーアプリケーション
個々のイベントの画像とそれに由来する形態測定データは、幅広いフローサイトメトリーアプリケーションにほぼ際限なく利点をもたらします。機能には以下があります:
画像取得データを使用してゲートを設定することで、ダブレットやデブリを除外したり、画像でゲート精度を確認できます。
既存のフロープロトコル内で形態的に異なる集団を記録し、特性評価できます。
細胞間相互作用から偶発的イベントを可視化および識別できます。
ハイスループットで詳細な証拠写真を使用できます。
Attune Cytometricソフトウエア6.0の画像解析機能の使用します
細胞培養QCワークフローに高速イメージングを追加することで、品質の問題を迅速に検出できます
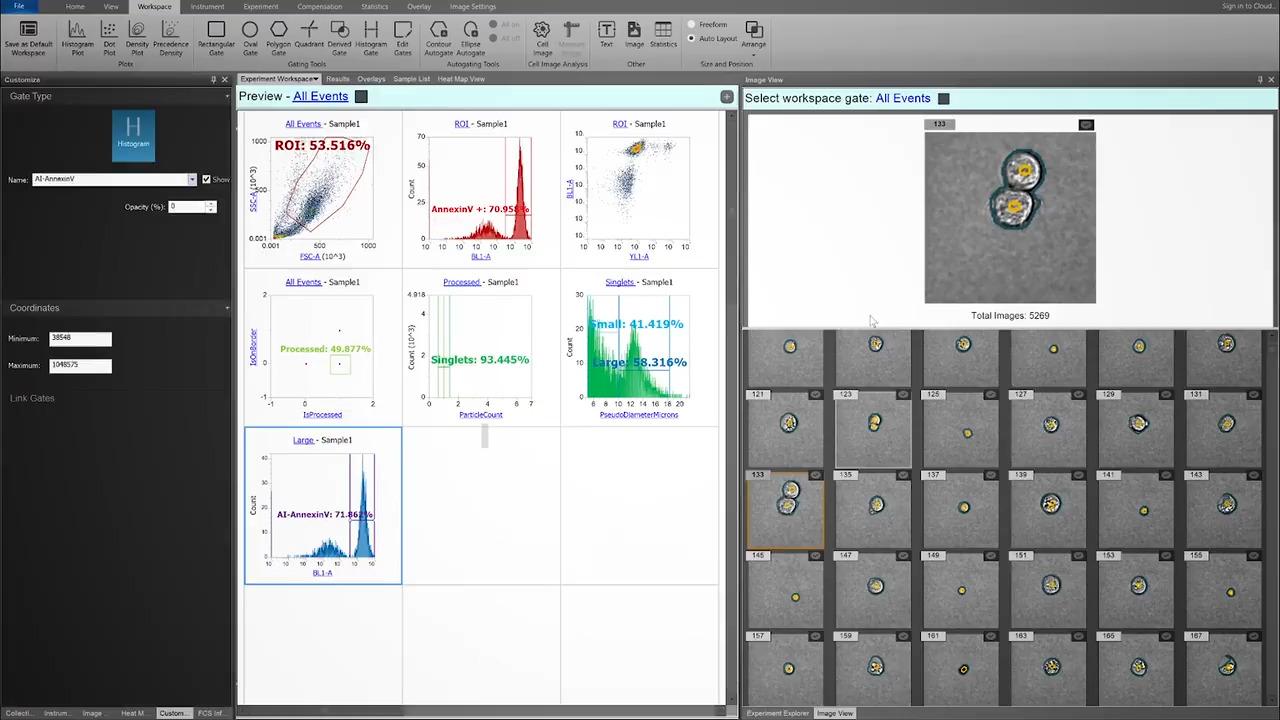
ゲーティングストラテジーの最適化。手動での確実なシングレットゲーティングでもエラーは発生しやすく、ほぼすべてのフローサイトメトリーアッセイにおいて、主観的な判断が必要です。イメージングはゲートの確認と調整に使用でき、目的のシングルセルだけを含めることが可能です。
ここでは、経験豊富なユーザーがシングレットを確実にゲーティングしました。この手動のシングレットゲートを評価すると、CytPixの画像由来パラメーターであるParticleCount(粒子数)により、このゲートは4%の凝集体を含むことがわかります。
もっとも重要なことはおそらく、これらのイベントには明らかに異なる表現型の細胞が含まれており、二重陽性イベント(特に希少集団)に関して誤った結論を導く可能性があることです。
細胞培養のQC。品質管理(QC)ワークフローに迅速なイメージングを追加することで、プロセスの早期に細胞培養の問題を検出して突き止めることができます。たとえば、あるラボでは、Ramos(リンパ腫)細胞培養の日常的な継代チェックにより、コンフルエントであるにもかかわらず、細胞数と生存率の低下が確認されました。追加調査で著しい微生物汚染が明らかになりましたが、それはいつどこで始まったのでしょうか?
この細胞株はAttune CytPix Flow Cytometerで解析していたため、研究者が画像をさかのぼり、少なくとも5日前の微生物感染が記録できていました。当時、初期の兆候は細胞片として片づけられていましたが、振り返って評価すると、培養中に問題のある細胞と特性を共有していたことが明らかになりました。感染を追跡することは、そのラボにおける、実験に不可欠な細胞株のスクリーニングおよび保護に対して追加手順を確立することに役立ちました。
細胞集団の特性評価。画像から得られた形態学的情報を、フローサイトメトリーデータの豊富な知見に加味できます。たとえば図は、アネキシンVおよびPIを使用した従来のアポトーシスアッセイを示しており、細胞イメージングを追加して各集団の細胞を解析し、形態的に異なる特徴を明らかにしています。これらの洞察は、従来のマルチプレックス染色だけでは得られていないものでした。
細胞間相互作用の解析。 イメージングでは、細胞間の相互作用を確認することさえも可能です。図では、改変CAR T免疫療法細胞をRamos(リンパ腫)細胞と共インキュベートし、Attune CytPixフローサイトメーターで染色、取得、および撮影しました。Q2象限の画像(両方の染色で陽性、単一のイベントとして取得)は、CAR T細胞が明らかにRamos細胞を標的にしていることを示しており、改変細胞の効果が明確に証明されています。
当社は以前、CAR-T細胞とRamos細胞の相互作用をイメージングすることのパワーを実証しました。詳細を得るために、もっとも関心のある集団であるダブルポジティブイベントについて見てみましょう。拡張された画像由来のパラメーター(真円度と強度の歪み)を使用して、これらの集団の特性をさらに調査したり、これらのイベントでゲーティングをさらに明確化して、データの堅牢性を向上できます。ここでは、ゲーティングストラテジーによって画像ベースの定量パラメーターを使用することで、相互作用細胞を同時イベントから区別して、相互作用細胞をより正確に分析できることが示されています。
解析の機会を発見
Attune CytPixフローサイトメーターで撮影された細胞をバックゲーティングすることで、形態学的特徴を利用して、フローサイトメトリーデータのみでは明らかにならない興味深いサブ集団を発見することもできます。
たとえば、長期間にわたりインキュベートされた大腸菌細胞は、単一細胞に類似した短いコロニー形成ユニット(CFU)と、不完全な分裂環を持つ伸長構造の2種類のCFUに成長し、各細胞のおおよその長さで不完全な収縮を示します。従来のシングレットゲート(SSC-A vs SSC-H)でも、蛍光ゲート(SSC vs 核染色)でも、これらの集団を十分に分離しません。しかし、Attune CytPixイメージング強化型のフローサイトメーターを使用すれば、画像を表示およびグループ化し、その形態特性に基づいてCFUタイプをゲートできます。
2種類の大腸菌CFUタイプの識別。大腸菌細胞を37℃で一晩インキュベートした後、4℃で3日間インキュベートしました。サンプルは、Attune CytPixフローサイトメーターにより、100 µL/minで取りこみました。画像から、2種類のCFUが同定されます:(A)単細胞に類似した短いコロニーおよび(B)不完全な分裂環を持つ伸長構造。各集団の代表的な画像を示します。選ばれた画像でのバックゲーティングにより、2つの集団がFSC vs SSCドットプロット上ではっきり区別されていることが明らかです(オレンジ色のドット、左)。
ビデオおよびデモ
For Research Use Only. Not for use in diagnostic procedures.