Search Thermo Fisher Scientific
核酸电泳应用——制备型和分析型电泳

核酸电泳在许多分子生物学研究应用中都可用来检验实验结果,有时也可用于分离和纯化样品,以便进行后续应用。因此,常规核酸电泳的应用通常可以分为分析和制备两种类型,两者均依赖于分离、溶解和定量技术。这些应用包括:
1.用于确认实验结果的分析型电泳
在进入下一步工作流程或另一组实验之前,可使用分析型核酸电泳检验实验结果。正如下文所述,该方法主要针对凝胶中是否存在目标条带,以及条带的强度、迁移模式、迁移率和杂交情况进行评估。
a. 检验酶促合成、消化和克隆实验是否成功
核酸的电泳分析通常在以下技术(图1)后立即进行以确定实验的成功和效率:
- 在几个小时内,聚合酶链式反应或PCR 将目标序列的一个拷贝放大到数百万份拷贝。在终点PCR之后进行电泳,以确认靶标的扩增及其产量。(了解更多:PCR基础和应用程序)
- 在与限制酶反应以切割DNA底物上特定序列的限制消化反应后,在凝胶上运行的样品来确定DNA切割模式(以及消化完成的程度)。(了解更多:限制酶的基础和应用)
- 在分子克隆中,通过称为连接的过程将DNA片段插入载体中。在一些情况下,可以在连接后进行电泳以评估反应效率(图2)。然后将连接产物用于转化克隆生物体的感受态细胞,如 大肠杆菌繁殖,然后筛选形成的菌落以确定它们是否携带具有所需插入物的载体。PCR和限制性消化,两者通常都涉及电泳作为工作流程的一部分,是菌落筛选中常用的技术。(了解更多:分子克隆基础知识,转化基础知识和群体筛选方法)
- 逆转录是通过称为逆转录酶的酶合成与RNA模板(cDNA)互补的DNA。在cDNA合成并去除RNA模板后,产物可以在变性凝胶上运行以评估反应效率。对已知序列或已知长度的RNA进行逆转录时,该方法最为常用。(了解更多:逆向转录基础知识和应用程序)
- 体外转录是通过RNA聚合酶从DNA模板合成RNA。在DNA模板去除后,可将合成的RNA置于变性凝胶上电泳,以确认转录是否成功。(了解更多:体外转录基础知识)

图 1.通过电泳确认实验是否成功的常见分子生物学应用。
b. 通过凝胶电泳定量核酸样品
电泳可用于通过每个片段已知含量的的标准品或 Ladder来定量感兴趣的DNA或RNA条带。定量法中,常用的分光光度定量法会受到核苷酸、引物等污染物的影响。但电泳却可从这些污染物中分离目标样品,从而成为一种可靠的定量方法。
凝胶定量是通过比较样品中的一个条带的强度与Ladder中尺寸相似的条带来估算样品的数量(图3A)。理想情况下,当使用设计用于定量的Ladder时,应加载不同数量的Ladder以绘制含量与强度的标准曲线,以进行更精确的定量(图3B)。另外,用具有高灵敏度和宽动态范围的荧光染料染色核酸可进一步改善凝胶定量。一些凝胶成像仪配备了分析软件,用于对凝胶中样品进行更简单的定量分析,而其他凝胶成像仪则具有用于数据存储的云连通性。

图 3.(A)使用已知量的片段进行凝胶定量。(B)凝胶定量的标准曲线。
c. 分析样品纯度、完整度、片段化和合成效率
可以使用凝胶电泳来评估从其来源提取的核酸样品的纯度和完整性,以及样品片段化的成功以及合成后全长寡核苷酸的百分比。
- 污染RNA样品的基因组DNA,反之亦然,可以使用凝胶电泳检测样品纯度(图4A)。污染种类检测时需取决于所用核酸染色剂的灵敏度以及污染物含量。
- 使用凝胶电泳,提取后总RNA的完整性可以通过评估28S和18S rRNA的相对强度来检查,其中2:1比率指示完整的RNA。条带拖尾的存在,特别是在较低分子量下,表明RNA降解(图4B)。
- 一些方案需要核酸样品的片段化,例如在为染色质免疫沉淀( ChIP )和下一代测序( NGS)准备样品输入时 ,以获得适合下一步的片段大小。样品碎裂的效率可以通过凝胶电泳检测(图4C)。
- 合成后,由于<100%合成的偶联效率,寡核苷酸产物将含有全长以及截断或失效序列(即n-1,n-2等) } (了解更多:寡核苷酸合成)。电泳则可根据不同长度寡核苷酸的大小和构象来区分全长产物和失效序列。
图 4.通过凝胶电泳确定样品纯度、完整度和片段化。(A)在分开的凝胶上分析提取的基因组DNA和总RNA。红色箭头分别代表污染RNA和基因组DNA。污染RNA仅在电泳运行开始时(≤5分钟)能被检测到。(B)通过28S和18S rRNA的电泳和分析评估纯化的RNA的两个样品的完整性。(C)在凝胶上测定DNA片段化的效率和片段化DNA的分布。(M=分子量标准品。RNA样品在变性凝胶上运行。)
d. 检测混合样品中的目标序列
凝胶电泳是通过探针杂交检测核酸库中的靶序列的工作流程的关键部分(图5,图6)。其中,探针指的是具有已知序列的单链核酸,专用于通过碱基互补与目标序列结合。
- 对于DNA片段分析,Southern印迹法和限制性内切酶片段长度多态性( RFLP )分析是两种众所周知的技术,其中使用电泳来在目标检测之前分离样品( 图5 )。

图 5.分别使用southern和northern印迹法检测混合样品中的特定DNA和RNA序列。
- 对于RNA片段分析,northern印迹和核酸酶保护测定(NPA)也依赖于探针杂交来检测感兴趣的序列。除了输入是RNA(图5 ), northern blot遵循与Southern相同的工作流程。在核糖核酸酶保护实验(RPA)中,RNA探针与样品混合物中的目标序列结合。其余的单链RNA,例如未结合的探针和模板及其突出端,之后会被核糖核酸酶如RNase A / T1 mix消化。已结合的探针和样品则进行凝胶电泳,用于靶标的下游检测和分析。
e. 评估DNA构象和核酸-蛋白质复合物
如电泳考虑部分所讨论的,不同构象,相同序列的质粒DNA可能显示不同的电泳迁移率。该特征可用于评估DNA构象,以及提取后完整质粒的水平。
与蛋白质结合的核酸片段比未结合片段的电泳迁移速度慢,形式上被称为电泳迁移率变动分析(EMSA ),基于该原理的方法通常被称为凝胶移位或凝胶阻滞测定,因为结合的蛋白移位或延缓了核酸片段的迁移 凝胶(图7)。因此,实验的电泳步骤可“抓拍”到样品中结合型和游离型DNA的平衡情况。对于EMSA,应在凝胶制备和电泳中使用低离子强度缓冲液,以帮助在电泳过程中稳定核酸 - 蛋白质复合物。

图 7.电泳迁移率实验。
2.用于纯化核酸样品的制备型电泳
核酸凝胶电泳的制备型应用,指的是在电泳分析后从凝胶基质中纯化、提取分离的核酸。因此,此种用于凝胶纯化的电泳通常用作下游应用的制备步骤。此外,凝胶制备方法可与分析方法联合使用。
a. 制备型电泳的相关应用
制备型电泳常用于多种分子生物学技术和应用操作之后,最常见的有:PCR;限制性酶切消化;寡核苷酸合成,以及下一代测序(NGS)的片段化、末端修饰和连接步骤。
- 可从凝胶中纯化PCR 产物和限制酶消化的DNA用于下游应用,例如末端修饰,连接,克隆和测序。(了解更多:限制性内切酶克隆, PCR克隆)
- 在寡核苷酸合成之后,聚丙烯酰胺凝胶电泳是从盐和截短序列中分离和纯化全长寡核苷酸的主要方法之一。
- 对于Illumina和Ion Torrent NGS平台,作为测序文库制备的一部分,样品片段化,末端修饰并连接到衔接子上。在这些步骤之后,以称为大小选择的方法纯化特定大小范围(例如,200-300bp)的DNA片段,以不仅去除低分子量和高分子量片段,而且还去除衔接子,酶 以及来自前面步骤的试剂。片段筛选有助于确保输入样品具有长度均一的片段,从而实现具有高品质和一致性的测序[1]。凝胶电泳是尺寸选择的一种方法,因为在窄范围(图8 )中选择特定尺寸片段的效率高。

图 8.片段筛选前后的片段大小分布
b. 凝胶纯化概述
制备型电泳是从凝胶中分离和纯化核酸的关键步骤。核酸纯化通常先从凝胶基质上切割目标样品条带,然后再提取核酸。在进行凝胶纯化时,应注意以下事项:
- 为方便提取,应尽量缩小凝胶切割面积
- 防止在凝胶可视化过程中对核酸的损害
如果使用可紫外激发的染料(例如溴化乙锭)进行可视化,请尽量减少样品暴露于辐射的时间,对激发使用更长的紫外线波长(例如360 nm,而不是254 nm),并选择透射上的落射照明。可以被较低能量蓝光激发的荧光染料(如SYBR 染料)是样品可视化的更好备选方案,因为它们可以减少样品对辐射的损害。
由于琼脂糖和聚丙烯酰胺不同,两种凝胶基质的纯化策略通常不同,总结如下:
i. 琼脂糖凝胶纯化
从凝胶中切割出目标条带后,可通过加热融化琼脂糖。在1%凝胶浓度下,标准琼脂糖熔点是>90℃然而低熔点(LMP)琼脂糖> 在65℃熔化。 由于其熔点较低,使用LMP琼脂糖可以提高提取的核酸的完整性和产量。对于比加热更温和的方法,可考虑酶琼脂糖酶,以将琼脂糖链分解成寡糖。Agarase消化需要使用LMP琼脂糖,以便琼脂糖酶在LMP琼脂糖的低凝胶化温度下保持活性。
融化或消化琼脂糖后,可使用以下任意方法提取核酸[2]。第一种简单有效的核酸提取方法,是苯酚提取并结合乙醇沉淀。由于苯酚的毒性和将其作为有机废物处理的要求,目前流行的方法是在离液剂存在下通过将核酸与二氧化硅基色谱柱结合来分离核酸,然后将其从色谱柱中洗脱出来 (图9 )。

图 9.使用硅胶柱从凝胶中提取DNA。
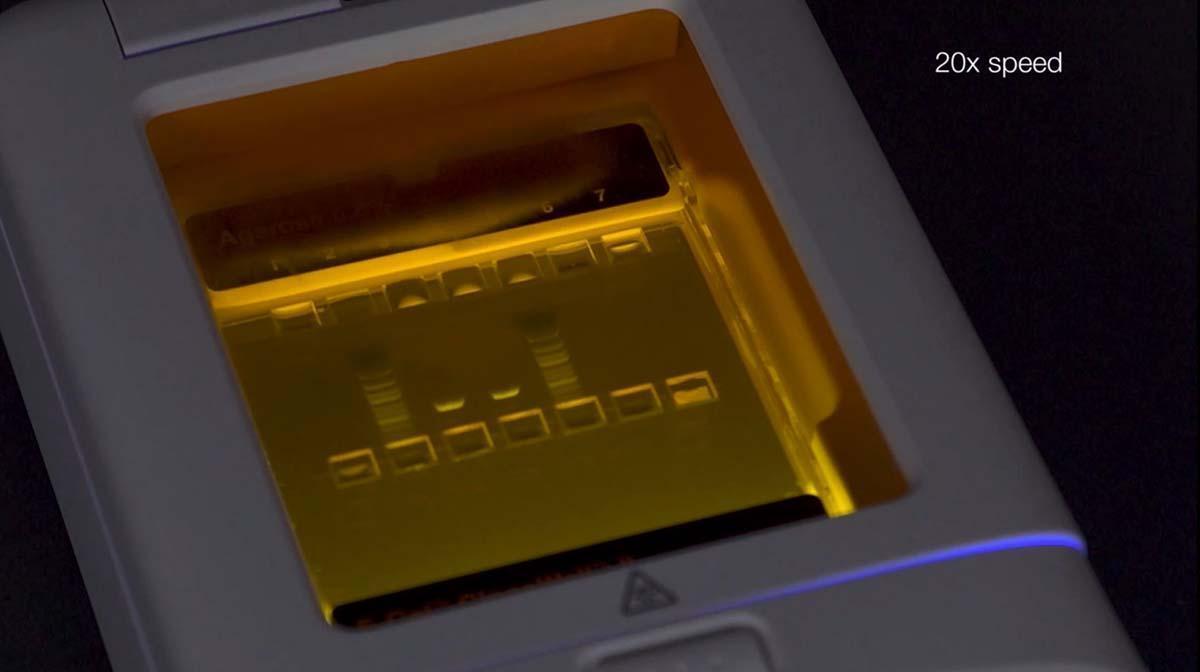
另一种分离特定条带的非常简单快速的方法是使用带有两排孔的特殊琼脂糖凝胶 [3]。将样品加载到上一排孔,随着电泳的进行,从底部一排孔回收所需大小的条带(图10 )。这种方法尤其适合于NGS文库片段制备和下游克隆实验。

图 10.使用特别设计的E-Gel预制琼脂糖凝胶只需三个步骤,即可回收和分离DNA条带。将样品加到上面一排孔中,随着凝胶电泳的进行,条带逐渐分开。当目标条带进入底部一排孔后,可用移液枪将其收集起来。
ii.聚丙烯酰胺凝胶纯化
由于聚丙烯酰胺凝胶是通过聚合反应形成的,因此,仅通过加热无法去除凝胶基质。通常通过“挤压和浸泡”或电洗脱方法从核酸聚丙烯酰胺凝胶中提取核酸[4](图11 )。

图 11.从聚丙烯酰胺凝胶中提取核酸。
综上所述,核酸凝胶电泳被广泛用于各种分子生物学工作流程和技术中。尽管电泳的基本方法自20世纪70年代以来几乎无甚改变,但在从限制性酶切消化至下一代测序的各种应用中,电泳已成为公认的强大核酸分离和分析技术。
参考文献
- Head SR, Komori HK, LaMere SA et al.(2014) Library construction for next-generation sequencing: overviews and challenges.Biotechniques56(2):61–4, 66, 68.
- Moore D, Dowhan, D, Chory J et al.(2002) Isolation and Purification of Large DNA Restriction Fragments from Agarose Gels.In: Ausubel FM et al.(editors) Current Protocols in Molecular Biology.Supplementary 59: Unit 2.6.
- Gibson JF, Kelso S, Skevington JH (2010) Band-cutting no more: A method for the isolation and purification of target PCR bands from multiplex PCR products using new technology.Mol Phylogenet Evol56:1126–1128.
- Chory J, Pllard JD (1999) Resolution and Recovery of Small DNA Fragments.In: Ausubel FM et al.(editors) Current Protocols in Molecular Biology.Supplementary 45: Unit 2.7.
资源
了解更多
相关产品
仅供科研使用,不可用于诊断目的。