Search Thermo Fisher Scientific
質量分析計によるタンパク質構造解析

タンパク質は構造によって機能が変化します
タンパク質の機能や作用機序について理解するにはタンパク質複合体のアセンブリや構造を調べることが非常に重要です。
サーモフィッシャーサイエンティフィックはその統合構造生物学ソリューションで、タンパク質の構造-機能相関研究の促進をリードしています。このソリューションは複合体および動的構造-機能相関を解析する質量分析およびクライオ電子顕微鏡(cryo-EM)の 技術を補完します。
高分子量の動的複合体の構造解析には、統合構造生物学として知られるアプローチの MS や cryo-EM 密度マップなど複数の相補技術が必要です。
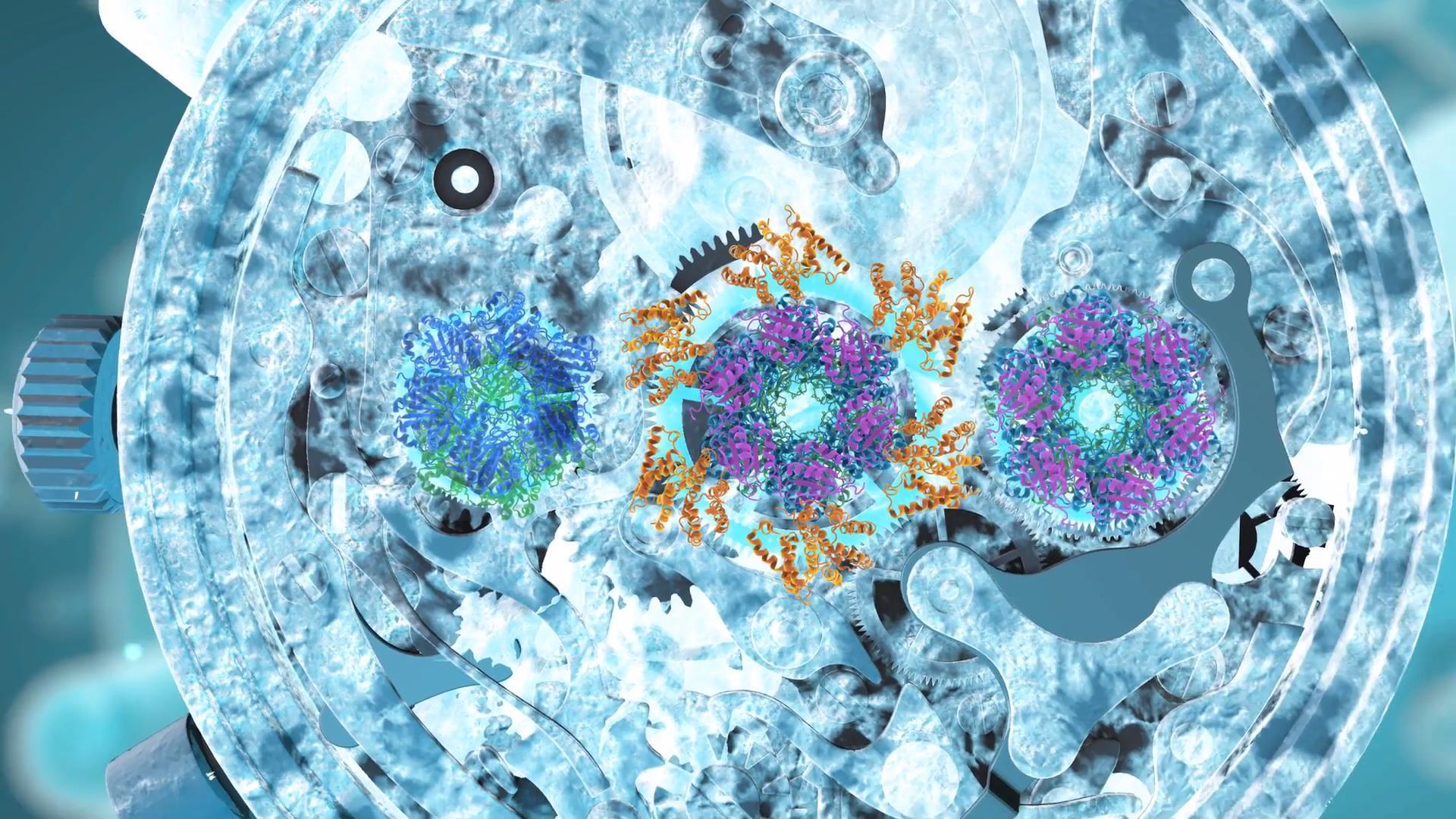
構造プロテオミクス MS ツールを活用した例として KaiA、KaiB、KaiC(シアノバクテリア概日時計の構成因子)の化学量論に関する研究があります。この研究では詳細に分析されたこの複合体のアセンブリをモニタリングした後、単粒子 cryo-EM を用いて構造解析を行いました。1
詳細情報
生体分子の質量分析は著しく発展し、構造生物学分野に影響を与えてきました。インタクトタンパク質レベルでは、ネイティブ MS により、非共有結合したタンパク質間およびタンパク質-リガンド複合体を解析することで、ネイティブ状態を保持したままタンパク質アセンブリの研究が可能です。ペプチドレベルでは、タンパク質消化物の LC-MS/MS による解析で、タンパク質のアミノ酸配列を決定でき、プロテオームデータベースからサブユニットを同定できます。
Thermo Scientific Orbitrap MS ソリューションはペプチドおよびタンパク質を中心とした研究戦略を推進し、さまざまな生化学的および構造的性質を明らかにします。実証済みの HRAM Orbitrap システムで高品質のデータを得ることにより、サンプルを信頼性高く詳細に分析でき、構造から機能解析までのプロセスを加速させる情報を得ることができます。
構造-機能相関研究に質量分析を取り入れる
MS 技術の発展により、構造生物学分野でのアプリケーションが、単一タンパク質レベルでもタンパク質複合体レベルでも複数登場しています。MS を基盤とした技術の主な特長はプロテオームスケールで実験が行えること、本来の生物学的状態のままタンパク質を分析できること、最低限必要なサンプルサイズを減らせることです。

質量分析カテゴリーによるタンパク質構造解析
タンパク質の形状およびドメイン構造を決定することで酵素のメカニズムに関するエビデンスが得られたり、性質不明のタンパク質の機能を予測できたりします。また立体構造の研究も、タンパク質-リガンド相互作用、翻訳後修飾、膜貫通ドメインに関するエビデンスを調べる第一歩となります。
タンパク質-リガンド相互作用は転写から翻訳、シグナル伝達まで、非常に多くの生物学的機能と関連しています。タンパク質-リガンド相互作用解析により、結合速度論、相互作用の相関、結合力に関する情報の多くが解明されます。
多くのタンパク質はアミノ酸残基に何らかの翻訳後修飾(PTM)を受けます。PTM により、タンパク質、核酸、脂質、その他コファクターの相互作用が制御されます。PTM はタンパク質の「ライフサイクル」中いつでも起こる可能性があり、触媒作用、タンパク質間相互作用、分解などの生物学的プロセスにおける機能に影響を与えます。
タンパク質同定はプロテオミクスワークフローにおいて非常に重要なパートです。タンパク質同定では、一つのタンパク質に焦点を絞ることもあれば、一つの生体サンプルに含まれる数百のタンパク質構成因子についてプロファイリングを行うこともあります。
多くの細胞内プロセスはタンパク質の複合体により制御されています。タンパク質複合体の各構成因子の化学量論を測定することで分子の全体的な機能を理解することができます。
多くの分子は独立してその機能を果たしていますが、生命活動においてはタンパク質同士が相互作用することが圧倒的に多くなります。こうした相互作用により、タンパク質の修飾、輸送、折りたたみ、シグナリングおよび細胞サイクルなどの細胞内プロセスが制御されています。
Orbitrap Fusion Lumos トライブリッド質量分析計でさらなる成果を達成
Thermo Scientific Orbitrap Fusion Lumos トライブリッド質量分析計は、高い分解能(1 M)、新たな解離手法(UVPD および ETD)、独自の内部キャリブレーション(IC)を追加してアップグレードできる最新鋭の質量分析計です。
Science 誌の編集者の協力により、統合構造生物学を総合的に解説したブックレットをダウンロードできます。このブックレットには Science 姉妹誌の記事、統合構造生物学の展望、トップレベル研究者のインタビューなどが掲載されています。
関連動画
化学量論的に詳しく同定された KaiCB および KaiCBA の集合体サンプルについて説明しています。このサンプルはネイティブ質量分析によってモニタリングしたため、単粒子クライオ電子顕微鏡および質量分析による構造解析を行うことができました。
参照文献
- Snijder, J., Schuller, J.M., Wiegard, A., Lössl, P., Schmelling, N., Axmann, I.M., Plitzko, J.M., Förster, F. and Heck, A.J., 2017.
Structures of the cyanobacterial circadian oscillator frozen in a fully assembled state.
Science, 355(6330), pp.1181-1184.