Search Thermo Fisher Scientific
相対定量

定量的プロテオミクス
個々のタンパク質の機能、タンパク質同士およびタンパク質と複雑な生物システムとの関わりを理解するには、関連する生物システムにおいてタンパク質存在量がどのように変化するか測定する必要があります。質量分析(MS)を用いた発見ベースの相対定量分析では、関連するタンパク質を同定することなく、複数のサンプルセットにおいて同時に相対的なタンパク質量の変化を測定できます。以下は相対定量分析によく用いられる 3 種の手法です。質量分析を用いて、タンパク質やペプチドの未知標的を相対定量できます。
培養細胞内のアミノ酸を使用した安定同位体標識(SILAC 法)では、13C または 15N で標識した「重い(heavy)」アミノ酸を用いてin vivoで生物サンプルを標識します。タンパク質合成の際、天然の「軽い(light)」アミノ酸が重いアミノ酸にで徐々に置換されます。異なる実験条件の細胞を、重いアミノ酸あるいは軽いアミノ酸のいずれかの培地で培養します。それぞれサンプルは標識されているので、回収した細胞は混合可能で、その後のすべての処理を混合サンプルに対して行うことができます。サンプル操作のバラつきを軽減できるため、より精確な定量が実現します。フラグメンテーションには CID、ETD、EThcD、HCD が用いられます。
Thermo Scientific tandem mass tag(TMT)試薬は、SILAC法の代替となりうるアイソバリックタグです。最大 10 種類までの生体試料サンプルの同時測定でき、ペプチドを同定しながら存在量の変化を相対定量できます。典型的なワークフローでは、実験条件の異なるそれぞれのサンプルに対し、異なるアイソバリックタグを用いてラベルします。処理後のサンプルを等量ずつ混合し、LC-MS で分析します。TMT ラベルペプチドがフラグメンテーションを受けると、用いたそれぞれのタグから産出する固有の質量のレポーターイオンがMS/MS スペクトルで検出されます。各レポーターイオンの強度をコントロールと比較して、タンパク質を定量します。
SILAC や TMT に代わる費用対効果に優れた本手法では、タンパク質を同位体標識することなく、タンパク質存在量の変化を複数のサンプル間で比較します。サンプルを個別に測定し、固有のペプチドイオンに対応するシグナルを LC タイムスケール上のイオンピークとして面積算出し、その後、個々の測定を比較してイオンピークのアライメントを実施します。ラベルフリー定量の主なメリットは、比較できるサンプル数に制限がないこと、サンプルの起源を問わず分析できること、さまざまな解離法(CID、HCD、ETD、EThcD)を用いてペプチドを同定できることです。
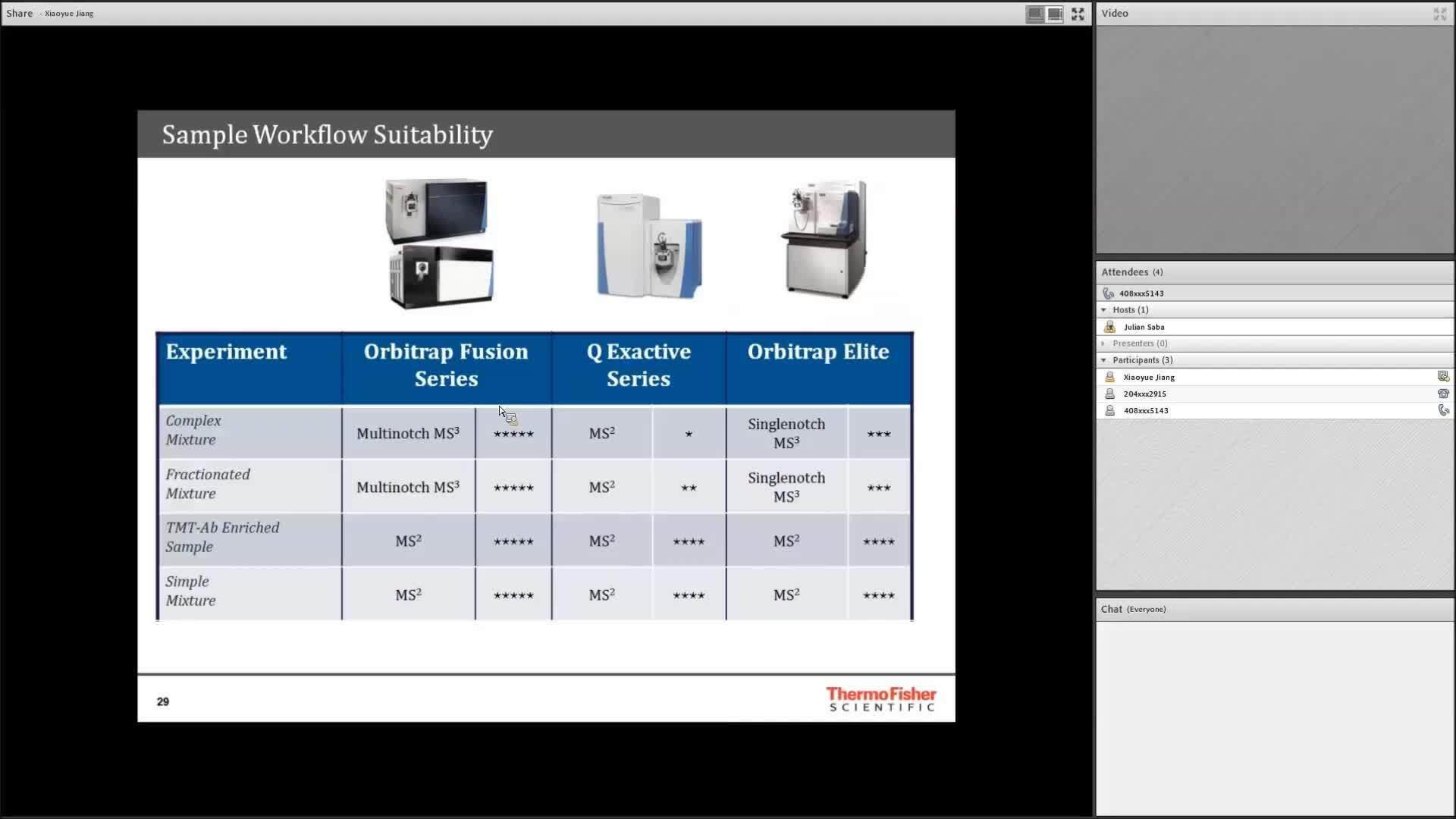
この説明用プレゼンテーションにより、アイソバリックタグを用いた定量プロテオミクス(すなわち TMT マルチプレックス)の全体像を把握できます。サンプル調製から装置の設定、データ解析に至るまでの各ステップについて詳しく概説されており、分析を確実に成功させるために役立ちます。